��Ŀ����
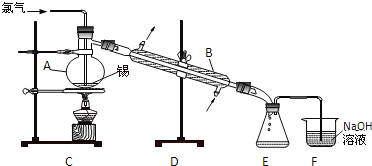
����Ŀ��ʵ������������ƿ�м�NaBr������ˮ��95%���Ҵ���Ũ���ᣬ�þƾ��ƶ���ƿ�ȣ��߷�Ӧ��������������������ˮ���ռ�����á����п��ܷ����ĸ���Ӧ�У�2HBr+H2SO4��Ũ����Br2+SO2![]() +2H2O
+2H2O
���������գ�
��1���Ʊ�������Ļ�ѧ����ʽΪ��_________��_______��
��2����Ӧ�м�������ˮ���ܲ�����������__________��ѡ���ţ�
A ��ֹ�����鱻Ũ�������� B �����廯��Ļӷ�
C ʹ��Ӧ�����ֲ� D �ܽ��廯��
��3��Ϊ�˱�֤�����������ȺͿ��ƺ��£����ȷ�����ò���________��
��4�����ñ߷�Ӧ������IJ�����ƣ�����ҪĿ����_________��
��5�����������ˮ���ռ�����õ�������___________��
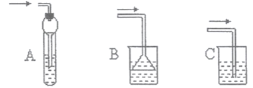
��6������װ����ʵ���м�������HBr���壬���ܷ�ֹҺ�嵹������__________��ѡ���ţ�
��7���ֲ�Ʒ��ˮϴ�Ӻ��л����Գʺ���ɫ������ȥ�����ʣ��ɼ�����Լ�Ϊ________��ѡ���ţ�
A �⻯����Һ B ����������Һ C ����������Һ
��8�����²��裬�����ڼ�������������Ԫ�أ�����ȷ�IJ���˳���ǣ�ȡ���������飬Ȼ��_______��
���𰸡�NaBr+H2SO4![]() NaHSO4+HBr C2H5OH+HBr
NaHSO4+HBr C2H5OH+HBr![]() C2H5Br+H2O C ˮԡ���� ʹ��Ӧƽ�������ƶ�����߲���IJ��� ������������ˮ���ܶȱ�ˮ�� A B ����������������ˮ��Һ�����ȣ���ȴ����������ϡ���ᣬ�ټ�����������Һ
C2H5Br+H2O C ˮԡ���� ʹ��Ӧƽ�������ƶ�����߲���IJ��� ������������ˮ���ܶȱ�ˮ�� A B ����������������ˮ��Һ�����ȣ���ȴ����������ϡ���ᣬ�ټ�����������Һ
��������
Ũ������廯�Ʒ�Ӧ�����廯�⣬Ȼ�������廯����Ҵ���Ӧ�Ʊ������飬��Ũ�������ǿ�����ԣ����ܽ��廯�����������嵥�ʣ�ʹ��Һ�ʳ�ɫ��Ȼ��������ˮ��ȴ�����ռ������飻�������ܹ�������������Һ����ȡ����Ӧ�����Ҵ����廯�ƣ��廯���ܹ�����������Һ��Ӧ���ɵ���ɫ������
��1���廯����Ũ�����ڼ��������·�Ӧ�����廯�⣬�䷴Ӧ����ʽΪ��NaBr+H2SO4![]() NaHSO4+HBr���廯�����Ҵ�����ȡ����Ӧ���������飬�䷴Ӧ����ʽΪ��C2H5OH+HBr
NaHSO4+HBr���廯�����Ҵ�����ȡ����Ӧ���������飬�䷴Ӧ����ʽΪ��C2H5OH+HBr![]() C2H5Br+H2O��
C2H5Br+H2O��
��2���廯�Ƽ�������ˮ����Ӧ�м���������ˮ�����ܽ�NaBr���廯�⼫������ˮ����Ũ�������ǿ�����ԣ�����NaBr����������ԭ��Ӧ��Ϊ���ٸ���Ӧ���������ȼ�ˮϡ�ͣ���������Ũ�ȣ��ɼ����廯����������ʴ�Ϊ��C��
��3��������ķе���38.4�������ƺ��£�38.4��������ˮԡ���ȣ�ˮ����������¶Ȳ�����100����Ϊ�˱�֤�����������ȺͿ��ƺ��£�һ�����ˮԡ���ȣ�
��4����ȡ�߷�Ӧ������IJ�����������ʱ�������������������Ũ�ȣ��ɴ�ʹƽ�������ƶ�����������Ҵ���ת���ʣ�
��5��������Ϊ�л���ܶȱ�ˮ����������ˮ���������������ˮ���ռ����ռ��ʹ�ˮ�з��룻
��6��A��HBr���弫������ˮ�����ڼ�������ˮ�����壬����װ���еĵ������������ӣ���������β��ֿռ���л������ã���ˮ���������ڣ��ձ���Һ���½����ڵ��ܿڣ�Һ�������䵽�ձ��У��ܷ�ֹ��������A���ϣ�
B��HBr���弫������ˮ�����ڼ�������ˮ�����壬����װ���еĵ�������©�����뵽Һ���У����ܷ�ֹ��������B�����ϣ�
C��HBr���弫������ˮ��������������ˮ�У�������������ˮ������װ����ѹǿ���罵�ͣ�������ѹѹ��Һ����룬������������C�����ϣ�
��ѡ��A��
��7���ֲ�Ʒ��ˮϴ�Ӻ��л����Գʺ���ɫ���������������ܽ���Br2��Ե�ʣ���������������Һϴ�ӳ�ȥ����������������Һ�������������ƣ���Ϊ�˷�ֹC2H5Br��ˮ�⣬���õ⻯����Һ������Ϊ�嵥����⻯�ط�Ӧ�����ɵⵥ�ʣ��ⵥ�����������ܻ��ܣ����ܴﵽ���ӵ�Ŀ�ģ��ʴ�Ϊ��B��
��8������������ԭ�Ӳ��������룬��ͨ��ȡ����Ӧ����ԭ��ȡ����Ȼ���������������飬�������Ϊ��ȡ�������������Թ��У�����������������ˮ��Һ�����ȣ���ȴ���ȼ���������ϡ���ᣬ�ټ�����������Һ��

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�