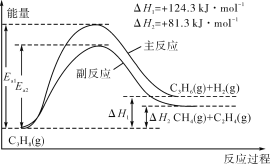
题目内容
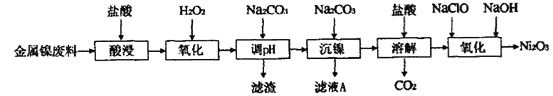
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易粉碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产Ni2O3的工艺流程如下:
下表为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度为1.0 mol·L-1):
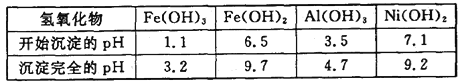
回答下列问题:
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是___________。(写两点即可)
(2)酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+、Al3+等。加H2O2的作用是__________,其离子方程式为______________________。
(3)在沉镍前,需加Na2CO3控制溶液pH的范围为__________。
(4)沉镍的离子方程式为_____________________。
(5)氧化生成Ni2O3的离子方程式为___________________。
【答案】升高温度;增加盐酸的浓度;粉碎;搅拌 把Fe2+氧化为Fe3+ 2Fe2++2H++H2O2=2Fe3++2H2O 4.7≤pH<7.1 Ni2++CO32-=NiCO3↓ 2Ni2++ClO-+4OH-=Ni2O3+Cl-+2H2O
【解析】
以金属镍废料生产Ni2O3,由流程可知,酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化Fe2+为Fe3+,加入碳酸钠溶液调节溶液的pH,使Fe3+、Al3+全部形成Al(OH)3、Fe(OH)3沉淀,过滤后向滤液中再加入碳酸钠沉淀镍离子得NiCO3沉淀,滤液A中含有NaCl等物质,将NiCO3经洗涤后再溶于盐酸得氯化镍溶液和二氧化碳,向溶液加入次氯酸钠和氢氧化钠溶液反应生成Ni2O3。
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是升高温度、增大盐酸浓度、粉碎、搅拌等;
(2)在酸性条件下H2O2具有氧化性,可以把Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)沉镍前要将Fe3+、Al3+沉淀完全,而镍离子不能形成沉淀,根据溶液的pH与金属氢氧化物沉淀的关系表格数值可知:溶液的pH值控制在4.7≤pH<7.1;
(4)沉镍时Ni2+与CO32-形成NiCO3沉淀,反应的离子方程式为Ni2++CO32-=NiCO3↓;
(5)NaClO中Cl元素化合价为+1价,反应后变为NaCl中的-1价,Cl元素由+1价降为-1价,而Ni由反应前NiCl2中的+2价升高到Ni2O3中的+3价,根据电子守恒、电荷守恒及原子守恒,可得Ni2+氧化生成Ni2O3的离子方程式为:2Ni2++ClO-+4OH-=Ni2O3+Cl-+2H2O。