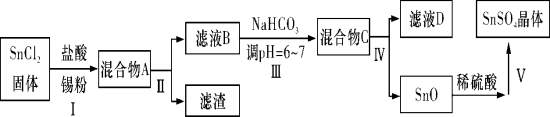
题目内容
【题目】某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为
A.0.80 B.0.85 C.0.90 D.0.93
【答案】A
【解析】
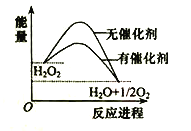
试题分析:A.H2的燃烧热必须是1mol物质燃烧生成最稳定的氧化物液态水时所放出的能量,故A错误;B.当反应物总能量>生成物总能量,则反应是放热反应,△H<O,故B正确;C.中和热是强酸和强碱的稀溶液发生中和反应生成1mol水时,所放出的热量,1molNaOH的氢氧化钠固体与含0.5molH2SO4的稀硫酸混合后,固体氢氧化钠溶解放热,反应放出热量大于57.3 kJ,故C错误;D.如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.原子的能量比分子的能量高,所以原子灰结合成分子形成化学键放出热量,即2H=H2 放出热量,则2E1>E2,故D错误。故选B。根据电子守恒可知,FexO被氧化为Fe3+转移的电子数和Cl2转移的电子数相等.标准状况下112mL Cl2转移电子数为![]() ×2=0.01mol.则有:
×2=0.01mol.则有:![]() ×(3-
×(3-![]() )×x=0.01mol,解得x=0.8。故选A。
)×x=0.01mol,解得x=0.8。故选A。

练习册系列答案
相关题目