题目内容
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn2+易水解、易被氧化;SnCl4极易水解。请按要求回答下列相关问题:
(1)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
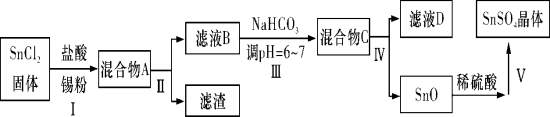
①步骤Ⅰ加入Sn粉的作用: __________________及调节溶液pH。
②步骤Ⅲ生成SnO的离子方程式:____________________________。
③步骤Ⅳ中检验SnO是否洗涤干净的操作是____________ ______,证明已洗净。
④步骤Ⅴ操作依次为____________、____________、过滤、洗涤、低温干燥。
(2)SnCl4蒸气遇氨气及水蒸气呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________________。
【答案】(1)①防止Sn2+被氧化为Sn4+
②Sn2++2HCO3-===SnO↓+2CO2↑+H2O
③取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀
④蒸发浓缩、冷却结晶
(2)SnCl4+4NH3+4H2O===Sn(OH)4+4NH4Cl
【解析】
试题分析:(1)① 步骤Ⅰ加入Sn粉和盐酸共同溶解SnCl2极固体,其中Sn粉的作用是防止Sn2+被氧化为Sn4+;
②步骤Ⅲ为滤液B中的Sn2+与NaHCO3反应生成SnO的反应,离子方程式为Sn2++ 2HCO3-= SnO↓+2CO2↑+ H2O;
③步骤Ⅳ中检验SnO是否洗涤干净,主要是看有无残留的氯离子,所以可取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察有无白色沉淀生成;
④步骤Ⅴ的目的是由硫酸亚锡溶液制得晶体,其步骤为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥;
(2)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,根据其现象可推知其反应的化学方程式为SnCl4+4NH3+4H2O===Sn(OH)4+4NH4Cl。