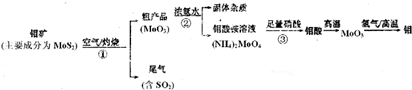
题目内容
14.现有下列物质:①葡萄糖粉末;②淀粉溶液;③Mg;④CuO;⑤KHCO3;⑥AgNO3;⑦雾;⑧Ca(OH)2固体;⑨氯化氢气体;⑩熔融NaC1.(1)选择合适的物质填入下表(混合物、氧化物、盐( )内填入对应物质的序号即可)
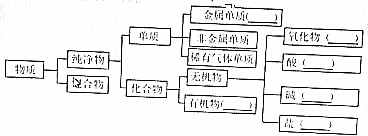
(2)如图的分类方法称为树状分类法.
(3)上述状态下能导电的有③⑩:(填写序号,下同)
(4)用一束平行光照射,能够产生丁达尔效应的是②⑦
(5)挑选上述物质,按照要求书写离子方程式:氧化还原反应Mg+2H+=Mg2++H2↑:大量⑤与少量澄清⑧溶液参与的非氧化还原反应Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,.
分析 (1)根据物质的组成和结构来分析;
(2)根据图示来分析;
(3)物质能导电,要么有自由移动的电子,要么有自由移动的离子,据此分析;
(4)能产生丁达尔效应的为胶体;
(5)具有强氧化性和强还原性的物质之间易发生氧化还原反应;过量型的反应在书写时,设量少的物质为1mol,根据这1mol物质的需要来确定所消耗的过量物质中的离子的种类和物质的量.
解答 解:(1)①葡萄糖为有机物;②淀粉溶液为胶体;③Mg为金属单质;④CuO为氧化物;⑤KHCO3为盐;⑥AgNO3为盐;⑦雾为胶体;⑧Ca(OH)2为碱;⑨氯化氢为酸;⑩熔融NaC1为盐.故为金属单质的为③;是有机物的为①;是氧化物的为④;是酸的是⑨;是碱的是⑧;是盐的是⑤⑥.
故答案为:是金属单质的为③;是有机物的为①;是氧化物的为④;是酸的是⑨;是碱的是⑧;是盐的是⑤⑥.
(2)根据图示可知为树状分类法,故答案为:树状分类;
(3)物质能导电,要么有自由移动的电子,要么有自由移动的离子.①葡萄糖不导电;②淀粉溶液中淀粉不能电离,故不导电;③Mg为金属单质,能导电;④CuO不导电;⑤KHCO3不导电;⑥AgNO3导电;⑦雾不导电;⑧Ca(OH)2不导电;⑨氯化氢不导电;⑩熔融NaC1有自由移动的离子,能导电.
故答案为:③⑩;
(4)能产生丁达尔效应的为胶体,而为胶体的是②淀粉溶液和⑦雾,故答案为:②⑦;
(5)具有强氧化性和强还原性的物质之间易发生氧化还原反应,而Mg有较强还原性,盐酸溶液中的H+有较强氧化性,两者能发生氧化还原反应:Mg+2H+=Mg2++H2↑;设量少的Ca(OH)2为1mol,而由于1molCa(OH)2中含1molCa2+和2molOH-,故需要消耗2molHCO3-,故离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故答案为:Mg+2H+=Mg2++H2↑;Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-.
点评 本题考查了电解质和非电解质的判断及能导电的物质,注意能导电的物质不一定是电解质,电解质不一定导电,为易错点.题目难度不大.

 阶梯计算系列答案
阶梯计算系列答案| A. | 通过饱和食盐水除去Cl2中的HCl | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| D. | 通过NaOH溶液除去CO中混有的CO2 |
| A. | 8.00g | B. | 16.0g | C. | 25.0g | D. | 12.5g |
| A. | 树立“同呼吸、共奋斗”的行为推测,倡导节约、绿色消费方式和生活习惯 | |
| B. | 用浸泡过的高锰酸钾的硅藻土来吸收香蕉产生的乙烯,达到保鲜的目的 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型有机高分子材料 | |
| D. | 雾霾天气的形成与机动车辆猛增和尾气超标有关 |
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
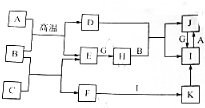 有关物质的转化关系如图所示(部分物质和条件已略去).A、C、E、G是中学化学中的常见单质,其中G呈黄绿色.E在G中燃烧发生苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀.请回答下列问题:
有关物质的转化关系如图所示(部分物质和条件已略去).A、C、E、G是中学化学中的常见单质,其中G呈黄绿色.E在G中燃烧发生苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀.请回答下列问题: .
.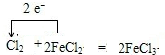 .
. )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).