题目内容
已知NaCl(s)+H2SO4(浓) NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于100g水中,若所得盐酸的密度为1.1 g/mL,则盐酸的物质的量浓度为多少?
 NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于100g水中,若所得盐酸的密度为1.1 g/mL,则盐酸的物质的量浓度为多少?
(7分)
解:(1)设生成HCl的质量为x
NaCl(s)+H2SO4(浓) NaHSO4+HCl↑
NaHSO4+HCl↑
58.5g 36.5g
117g xg 1分
x="73" g 1分
V(HCl)=22.4L·mol-1×73g/36.5g/mol = 44.8(L) 1分
(2)
C(HCl)=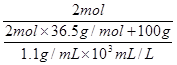 ≈12.7mol/L 4分
≈12.7mol/L 4分
解:(1)设生成HCl的质量为x
NaCl(s)+H2SO4(浓)
 NaHSO4+HCl↑
NaHSO4+HCl↑58.5g 36.5g
117g xg 1分
x="73" g 1分
V(HCl)=22.4L·mol-1×73g/36.5g/mol = 44.8(L) 1分
(2)
C(HCl)=
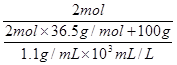 ≈12.7mol/L 4分
≈12.7mol/L 4分试题分析:(1)NaCl的物质的量为117g/(58.5g/mol) =2mol,
设生成HCl的物质的量为x,
NaCl(s)+H2SO4(浓)
 NaHSO4+HCl↑
NaHSO4+HCl↑1 1
2mol x
1/1=2mol/x
解得x=2mol,
HCl在标况时的体积为2mol×22.4L/mol=44.8L,
答:产生的HCl在标况时的体积为44.8L;
(2)HCl的物质的量为2mol,
C(HCl)=
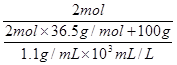 ≈12.7mol/L
≈12.7mol/L答:盐酸的物质的量浓度为12.7mol/L。
点评:本题较简单,考查学生利用化学反应方程式的计算,明确氯化钠的质量来计算物质的量代入化学反应方程式来计算即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CuSO4 + SO2↑+ 2H2O 。
CuSO4 + SO2↑+ 2H2O 。