题目内容
6.(1)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是共价化合物(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是氯化铝在熔融状态下不能导电.(2)NaHSO4熔融状态下电离,破坏了离子键,写出电离方程式NaHSO4═Na++HSO4-.
(3)请写出298K,101KPa时,下列反应的热化学方程式:用CO(g)还原1mol Fe2O3(s)放热24.8KJFe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol.
分析 (1)氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,可知熔沸点低,与分子晶体的性质相似;
(2)离子晶体在熔融时破坏离子键;
(3)根据还原1mol Fe2O3(s)放热的热量结合方程式计算.
解答 解:(1)氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,可知熔沸点低,与分子晶体的性质相似,可知由共价键形成的共价化合物,可利用熔融状态下不能导电来实验证明,
故答案为:共价化合物; 氯化铝在熔融状态下不能导电;
(2)离子晶体在熔融时破坏离子键,NaHSO4属于离子晶体熔融状态下电离出钠离子和硫酸氢根离子,则电离方程式为:NaHSO4(熔融)=Na++HSO4-,
故答案为:离子; NaHSO4═Na++HSO4-;
(3)用CO(g)还原l mol Fe203(s),放热24.8kJ,标注物质聚集状态和对应焓变得到热化学方程式为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol.
点评 本题考查较为综合,涉及化学键、晶体的类型、热化学方程式的书写,为高频考点,根据晶体的构成微粒及微粒间的作用力来分析解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16. 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )| A. | 电解时惰性电极应与直流电源的负极相连 | |
| B. | 通电后阴极室产生的现象为:产生无色气体,溶液由无色变黄色 | |
| C. | 制备过程中总的离子方程式为:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若实验开始时在右室中加入38.8克的K2CrO4,tmin后测得右室中K与Cr的物质的量之比为3:2,此时电路中转移电子的物质的量为0.1mol |
17.有机化合物没食子茶素(EGC)结构简式如图所示.下列关于EGC的叙述中正确的是( )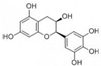

| A. | 分子中所有的原子共面 | |
| B. | 1mol EGC与4mol NaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,一定条件下可发生加成反应 | |
| D. | 易发生水解反应和显色反应,一定条件下可发生消去反应 |
14.有机物: 有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
 有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.下列说法正确的是( )


| A. | c为正极、d为负极 | |
| B. | 电路中电子的流动方向:b-d-CuCl2溶液-c-a | |
| C. | 电解过程中,d电极质量增加 | |
| D. | 电解过程中,氯离子浓度不变 |
11.下列变化中,不需破坏化学键的是( )
| A. | 加热氯化铵 | B. | 干冰气化 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
18.砷(As)与其化合物常被运用在农药、除草剂、杀虫剂中.已知它与氮同主族,而与钙同周期,下列关于砷的有关描述中正确的是( )
| A. | 原子序数为23 | |
| B. | 最高价氧化物为As2O3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为AsH3,稳定性强于NH3 |
15.由短周期元素形成的化合物有许多组成情况如果化学式为XY2,下列叙述正确的( )
| A. | 如果XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 如果X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 | |
| C. | 如果X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 如果XY2是离子化合物,则X与Y的原子序数可能相差9 |