题目内容
4.如图是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(石蕊试液)、E(浓硫酸)、H(NaOH溶液).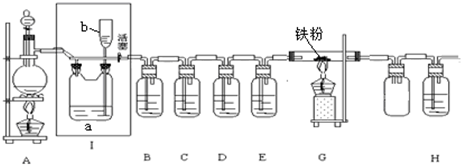
回答下列问题:
(1)A为氯气发生装置,圆底烧瓶中盛放MnO2,分液漏斗中盛放浓盐酸.反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯.装置B中的现象是产生白色沉淀;装置D中的现象是紫色石蕊试液先变红后褪色;
C中反应的化学方程式是2FeCl2+Cl2=2FeCl3;G中反应的化学方程式是2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(3)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作关闭Ⅰ处活塞;装置Ⅰ中的现象是Ⅰ处a瓶内液面下降,b中液面上升.
(4)热的氯气进入H溶液中,不但有NaClO生成,还有NaClO3生成.若n(NaClO):n(NaClO3)﹦1:2,则氧化剂与还原剂的物质的量比为11:3.
分析 (1)二氧化锰和浓盐酸反应生成氯化锰和氯气和水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)装置B中氯气溶于水生成盐酸和次氯酸,盐酸和硝酸银反应生成氯化银白色沉淀.装置D中氯气和水反应生成的盐酸和次氯酸,盐酸能使紫色石蕊试液先变红,次氯酸能使之褪色.装置C中,氯气和氯化亚铁反应生成氯化铁,G中铁和氯气反应生成氯化铁;
(3)移去酒精灯,但由于余热的作用,A处仍有氯气产生,为了防止氯气排到空气中,所以选择贮存氯气,所以关闭Ⅰ处活塞,氯气留在a中,可以看到Ⅰ处a瓶内液面下降,b中液面上升;
(4)假设生成次氯酸钠1mol和氯酸钠2mol,则转移电子为11mol,则生成氯化钠为11mol,所以做氧化剂的氯气和做还原剂的氯气的物质的量为11:3.
解答 解:(1)装置图分析可知实验室制备氯气利用二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)装置B中氯气溶于水生成盐酸和次氯酸,盐酸和硝酸银反应生成氯化银白色沉淀.装置D中氯气和水反应生成的盐酸和次氯酸,盐酸能使紫色石蕊试液先变红,次氯酸能使之褪色.装置C中,氯气和氯化亚铁反应生成氯化铁,方程式为:2FeCl2+Cl2=2FeCl3;G中铁和氯气反应生成氯化铁,方程式为:2Fe+3Cl22FeCl3;
故答案为:产生白色沉淀,紫色石蕊试液先变红,后褪色;2FeCl2+Cl2=2FeCl3;2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(3)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,可以利用Ⅰ装置进行储气,把装置Ⅰ中的活塞关闭,随氯气增多,b中压强增大,液体被压入c中;b瓶内液面下降,c中液面上升,
故答案为:关闭Ⅰ处活塞,Ⅰ处a瓶内液面下降,b中液面上升;
(4)假设生成次氯酸钠1mol和氯酸钠2mol,则转移电子为11mol,则生成氯化钠为11mol,所以做氧化剂的氯气和做还原剂的氯气的物质的量为11:3.
故答案为:11:3.
点评 本题考查了氯气实验室制备,氯气性质验证和除杂方法,反应产物判断,实验过程分析和氯气性质是解题关键,题目难度中等.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | K+、Fe2+、SO42-、ClO- | B. | NH4+、Mg2+、SO42-、NO3- | ||
| C. | K+、Al3+、S2-、Cl- | D. | Na+、Fe3+、Cl-、SO42- |
| A. | 加入浓硫酸 | B. | 煮熟 | C. | 变性 | D. | 盐析 |
| A. | 0.1mol•L-1的氨水100mL | B. | 0.1mol•L-1的醋酸50mL | ||
| C. | 0.05mol•L-1的醋酸100mL | D. | 0.05mol•L-1的硫酸100mL |
| A. | 双氧水可用于皮肤伤口消毒 | |
| B. | 水玻璃是制备硅胶和木材防火剂等的原料 | |
| C. | 生石灰和铁粉都是食品包装中常用的干燥剂 | |
| D. | 生活中可用电解饱和食盐水的方法制取消毒液 |
| A. | 1.0mol | B. | 0.7mol | C. | 0.6mol | D. | 0.4mol |

 请认真观察图,然后回答问题:
请认真观察图,然后回答问题: