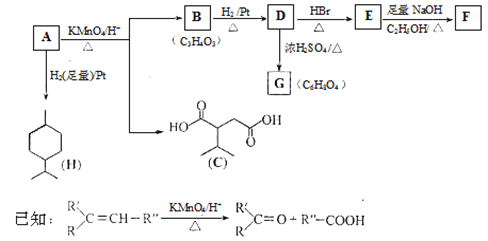
题目内容
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
【答案】 bc 2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3 低温加压下吸收CO,然后将铜液洗涤转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用 C>N>O>H 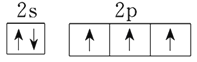 NH3和PH3的稳定性
NH3和PH3的稳定性 ![]() 2
2
【解析】(1)增大浓度、升高温度等,可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
(2)氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3,故答案为:2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
(3)正反应放热,铜液吸收CO,应使平衡向正向移动,则可在低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用,故答案为:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;
(4)铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径C>N>O>H;氮元素原子最外层电子排布的轨道表示式是![]() ;比较非金属性强弱,可根据氢化物的稳定性强弱,故答案为:C>N>O>H;
;比较非金属性强弱,可根据氢化物的稳定性强弱,故答案为:C>N>O>H;![]() ;NH3和PH3的稳定性;
;NH3和PH3的稳定性;
(5)CS2的电子式类似于CO2,电子式为![]() ,根据醋酸二氨合铜的化学式Cu(NH3)2Ac,铜离子为中心原子,配体为NH3,配位数为2,故答案为:
,根据醋酸二氨合铜的化学式Cu(NH3)2Ac,铜离子为中心原子,配体为NH3,配位数为2,故答案为:![]() ;2。
;2。