题目内容
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
【答案】C
【解析】试题分析:根据燃烧反应为放热反应,△H<0,由系数确定 d=2c<0;b=2a<0;d中生成的是液态水,热量多,绝对值比b气态水的大,但绝对值越大相应数值越小所以d<b<0,c 中生成的是液态水,热量多,绝对值比a气态水的大,但绝对值越大相应数值越小所以c<a<0;
解:A、c 中生成的是液态水,热量多,绝对值比a气态水的大,但绝对值越大相应数值越小所以c<a<0,故A错误;
B、d中生成的是液态水,热量多,绝对值比b气态水的大,但绝对值越大相应数值越小所以d<b<0,故B错误;
C、燃烧反应为放热反应,△H<0,由系数确定 d=2c<0;b=2a<0,故C正确;
D、燃烧反应为放热反应,△H<0,由系数确定 d=2c<0;b=2a<0,故D错误;
故选:C.

【题目】(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下 转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
① 请结合上表数据,写出NO与CO反应的化学方程式________________________。
② 根据表中数据判断,温度T1和T2的关系是(填序号)_________________________。
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH= - 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为_________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
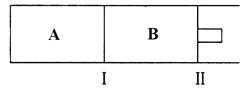
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将_______________(填“正向”、“逆向”或“不”)移动。