题目内容
【题目】(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下 转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
① 请结合上表数据,写出NO与CO反应的化学方程式________________________。
② 根据表中数据判断,温度T1和T2的关系是(填序号)_________________________。
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH= - 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为_________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
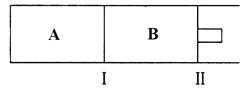
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将_______________(填“正向”、“逆向”或“不”)移动。
【答案】 2CO + 2NO![]() N2 + 2CO2 A 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol 10(L/mol)2 逆向
N2 + 2CO2 A 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol 10(L/mol)2 逆向
【解析】(1)①由表中数据可知,CO、NO、E、F的化学计量数之比为0.08:0.08:0.08:0.04=2:2:2:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,且该反应为可逆反应,故反应方程式为:2CO+2NO![]() 2CO2+N2;故答案为:2CO+2NO
2CO2+N2;故答案为:2CO+2NO![]() 2CO2+N2;
2CO2+N2;
②根据表中数据可知,温度由T1变为T2,平衡向正反应方向移动,由于正反应是放热反应,说明T1>T2;故答案为:A;
(2)①4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH= - 1266.8 kJ/mol,②N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,根据盖斯定律,将①-②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol,故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol;
(3)若在某件下,反应N2(g)+3H2(g)![]() 2NH3(g),在容器B中达到平衡,测得容器中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L,则此条件下的平衡常数K=
2NH3(g),在容器B中达到平衡,测得容器中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L,则此条件下的平衡常数K=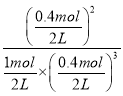 =10;保持温度和压强不变,向此容器内通入0.36mol N2,同温同压条件下,气体的体积之比等于物质的量之比,则此时容器体积V=
=10;保持温度和压强不变,向此容器内通入0.36mol N2,同温同压条件下,气体的体积之比等于物质的量之比,则此时容器体积V=![]() ×2L=2.4L,所以Q(c)=
×2L=2.4L,所以Q(c)= 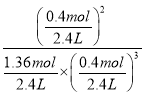 =10.6>10,反应逆向进行,故答案为:10;逆向。
=10.6>10,反应逆向进行,故答案为:10;逆向。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热.
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
E(kJmol﹣1) | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g),(已知1mol晶体Si中有2molSi﹣Si键),该反应的产生的热量为( )
Si(s)+4HCl(g),(已知1mol晶体Si中有2molSi﹣Si键),该反应的产生的热量为( )
A.吸收412 kJmol﹣1
B.放出412 kJmol﹣1
C.吸收236 kJmol﹣1
D.放出236 kJmol﹣1