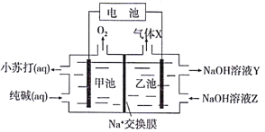
题目内容
【题目】甲胺(CH3NH2)的性质与氨相似。25℃时,实验室里用0.1mol/L的盐酸溶液滴定20mL0.1mol/L甲胺溶液,滴定曲线如图所示。(已知:AG=lg[c(H+)/c(OH-)])下列说法正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. 水的电离程度:d>c>b>a
C. Kb(CH3NH2·H2O)=1×10-5
D. b点溶液中存在:c(H+)-c(OH-)=c(CH3NH2·H2O)-c(CH3NH3+)
【答案】C
【解析】
a点0.1mol/L甲胺溶液c(OH-)=1×10—3mol/L,抑制水的电离;b点为半反应点,形成等浓度的氯化甲胺和甲胺混合溶液,溶液显碱性;c点为氯化甲胺和甲胺混合溶液,溶液显中性;d点为等浓度的氯化甲胺和盐酸混合溶液,溶液显酸性。
A项、20mL 0.1mol/L的盐酸溶液与20mL0.1mol/L甲胺溶液完全反应时,生成氯化甲胺溶液,溶液显酸性,定过程应该选择酚酞作为指示剂会导致测定结果偏低,应该选用甲基橙作指示剂,故A错误;
B项、d点为等浓度的氯化甲胺和盐酸混合溶液,,溶液显酸性,c点为氯化甲胺和甲胺混合溶液,溶液显中性,则水的电离程度: c>d,故B错误;
C项、a点0.1mol/L甲胺溶液c(OH-)=1×10—3mol/L,Kb(CH3NH2·H2O)=c(CH3NH3+)c(OH-)
/c(CH3NH2·H2O)≈1×10—3mol/L×1×10—3mol/L/0.1mol/L=1×10-5,故C正确;
D项、b点为半反应点,形成等浓度的氯化甲胺和甲胺混合溶液,由电荷守恒得:c(H+)+ c(CH3NH3+)=c(OH-)+ c(Cl-),由物料守恒得:2c(Cl-)= c(CH3NH2·H2O)+ c(CH3NH3+),两式联立得:2c(H+)+ 2c(CH3NH3+)=2c(OH-)+ c(CH3NH2·H2O)+ c(CH3NH3+),c(H+)-c(OH-)=1/2[c(CH3NH2·H2O)—c(CH3NH3+)],故D错误。
故选C。

 通城学典默写能手系列答案
通城学典默写能手系列答案