��Ŀ����
����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�ش��������⣺
(1)��Ӧ��ġ�H2=______________��
(2)��Ӧ���ܹ��Է����е�������__ (��ϵ��¶ȡ����� �ϸ��¶ȡ����κ��¶ȡ�)
(3)���£������ܱ������У����ڷ�Ӧ������˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����________��
A.���������ܶȲ��ٱ仯
B.��������ƽ����Է����������ٱ仯
C.CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1
D.�״��İٷֺ������ٱ仯
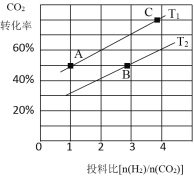
(4)���ڷ�Ӧ��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����____��
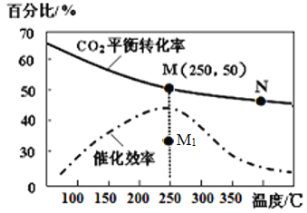
A.�����������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��M1
B.�¶ȵ���250��ʱ�����¶����״��IJ�������
C.M��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D.ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
(5)����1L�ܱ������г���3molH2��1molCO2������Ӧ��250��ʱ��Ӧ��ƽ�ⳣ��K=__________����Ҫ��һ����״����������ɲ�ȡ�Ĵ�ʩ��________��
���𰸡�+41.19kJ��mol-1�ϵ��¶�BDABD0.148����ѹǿ(�����¶�)
��������
(1) ��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
���ݸ�˹���ɣ���=����÷�Ӧ�ڵġ�H2= +41.19kJ��mol-1��
(2)��G=��HT��S<0ʱ����Ӧ�ܹ��Է����У��÷�Ӧ����S<0����H<0�����¶Ƚϵ�ʱ����Ӧ���ܹ��Է�������
(3)A�����������������������䣬�������Ƿ�ﵽƽ��״̬�����������ܶȶ����仯��������Ϊ�ж��Ƿ�ƽ������ݣ���A����B����Ӧǰ����������ʵ������ȣ���������ƽ����Է����������ٱ仯����˵����������ʵ������ٱ仯��˵���ﵽƽ��״̬����B��ȷ��C��ƽ�ⳣ��δ֪��CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1�������ж��Ƿ�ﵽƽ��״̬����C����D���״��İٷֺ������ٱ仯����˵���ﵽƽ��״̬����D��ȷ��
(4)A.��������Ӱ��ƽ���ƶ���ֻ�ܸı䷴Ӧ���ʣ���A����B. �¶ȵ���250��ʱ�����¶�����ƽ��������м״��IJ��ʼ�С����B����C�������¶ȶ�����̼��ƽ��ת���ʼ��ͣ�������ƽ�������ƶ�������M��ѧƽ�ⳣ������N����C��ȷ��D. Ϊ���CO2��ת���ʣ�ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ���͵��¶��½��з�Ӧ��ƽ��������У��������Ļ��ԡ���Ӧ���ʼ�С����D����ѡABD��
(5) ����1L�ܱ������г���3molH2��1molCO2����ͼ��M��ʱ������̼ת����50%��
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ��(mol) 1300
�仯��(mol) 0.51.50.50.5
ƽ����(mol) 0.51.50.50.5
K=![]() ����Ӧǰ�����������С����Ҫ��һ����״�������������ɲ�ȡ�Ĵ�ʩ������ѹǿƽ��������У�
����Ӧǰ�����������С����Ҫ��һ����״�������������ɲ�ȡ�Ĵ�ʩ������ѹǿƽ��������У�

 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�����Ŀ��ijʵ��С��ͬѧ���к͵ζ����к��ȵIJⶨ����ʵ�顣
������ͼ�Ǹ�С��ͬѧ��0.5000 mol/L������ζ�ijδ֪Ũ�ȵ�NaOH��Һ��ʾ��ͼ�͵�1�εζ�ǰ����ʢ������ĵζ�����Һ���λ�á���ش��������⡣

��1������A��������_______________��
��2����1�εζ����ı�Һ_________mL ��
��3����֪ÿ�εζ�������ȡ����NaOH��Һ�������Ϊ20.00mL����2��3��4�εζ��������±���ʾ��ͨ������ô���NaOH��Һ��ƽ��Ũ����___________mol/L��(������λ��Ч����)
ʵ�� ��� | ����NaOH��Һ�������mL�� | �ζ�ǰ����� ���������mL�� | �ζ�������� ���������mL�� |
2 | 20.00 | 1.20 | 21.20 |
3 | 20.00 | 2.24 | 22.26 |
4 | 20.00 | 1.50 | 21.48 |
��4���ζ������ɷֽ�Ϊ���¼��������õ�������������ˮϴ������
A������ƿ��ע��20.00 mL����NaOH��Һ��������2-3�η�̪��
B���ñ���Һ��ϴ��ʽ�ζ���2-3�Σ�
C���̶���װ����Һ����ʽ�ζ��ܣ����ڵζ��ܼ���ʹ֮������Һ�����������ݣ�
D��ȡ��HCl��Һע����ʽ�ζ������̶�0����2-3cm��
E������Һ����0��0���¿̶ȣ����¶�����
F������ƿ���ڵζ������棬�ñ�HCl��Һ�ζ����յ㲢���µζ���Һ��̶ȡ�
�����IJ���˳���ǣ��������ĸ��д��______________________________��
��5������жϵ���ζ��յ㣿_________________________________________��
��6���������B����ʡ�ԣ��Բⶨ�����Ӱ����_________����Һ����ʱ�����ζ�ǰ���ӣ��ζ����ӣ��Բⶨ�����Ӱ����______(���Ӱ�족����ƫ�ߡ�����ƫ�͡�)��
����������������Ѳ��Ũ�ȵ�NaOH��Һ���������װ�òⶨ�к��ȡ�
��50mL������50mL NaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��7����ͼʾ����װ�ô��ڴ�����ָ��_________________��
��8���������¶ȵ���10��ʱ����ʵ������Ӱ��ܴ�ʵ���õ��к�����ֵƫС����ԭ����___________________��
��9�����ʵ������ʼ�¶�Ϊt1�棬��Ӧ�������¶�Ϊt2�棬���к��ȵı���ʽΪ��H =___________�����кͺ���Һ�ı�����c=4.18J/(g.��)��
��10������ʵ�������¶���������������������ƫ�ͣ���ԭ����_________________��