题目内容
【题目】A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C﹣离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍.(1)A元素的符号;(2)B的单质;C;D .
【答案】Mg;Al;Cl;C
【解析】解:短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子为带2个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,可知M(AO)= ![]() =40g/mol,所以A的摩尔质量为40g/mol﹣16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al.Cˉ离子核外电子层数比A元素的离子核外电子层数多1,Cˉ离子核外电子数为18,故C为Cl元素;D元素原子最外层电子数是最内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则D为C元素.(1)由上述分析可知,A、B、C、D四种元素符号分别为:Mg、Al、Cl、C,所以答案是:Mg;(2)B的单质是铝单质;C是氯气;D是碳单质,所以答案是:Al、Cl、C.
=40g/mol,所以A的摩尔质量为40g/mol﹣16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al.Cˉ离子核外电子层数比A元素的离子核外电子层数多1,Cˉ离子核外电子数为18,故C为Cl元素;D元素原子最外层电子数是最内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则D为C元素.(1)由上述分析可知,A、B、C、D四种元素符号分别为:Mg、Al、Cl、C,所以答案是:Mg;(2)B的单质是铝单质;C是氯气;D是碳单质,所以答案是:Al、Cl、C.

【题目】甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素. 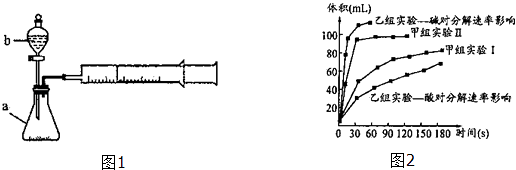
(1)仪器b的名称: .
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
甲组实验Ⅰ | 做实验参照 | 25 | 10mL 2%H2O2 | |
甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图2数据. ①由甲组实验得出的数据可知:浓度越大,H2O2分解速率(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是 .

