题目内容
100mL 0.1 mol·L-1HCI与等体积0.15 mol·L-1 Ba(OH)2溶液混合,求PH值(写出过程)。
pH=13
考查pH的有关计算
氯化氢的物质的量是0.1L×0.1mol/L=0.01mol
氢氧化钡的物质的量是0.1L×0.15mol/L=0.015mol
所以氢氧化钡是过量的根据反应式H++OH-=H2O可知
溶液中OH-的浓度是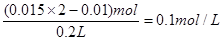
所以溶液中氢离子浓度是1×10-13mol/L因此溶液的pH=13
氯化氢的物质的量是0.1L×0.1mol/L=0.01mol
氢氧化钡的物质的量是0.1L×0.15mol/L=0.015mol
所以氢氧化钡是过量的根据反应式H++OH-=H2O可知
溶液中OH-的浓度是
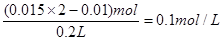
所以溶液中氢离子浓度是1×10-13mol/L因此溶液的pH=13

练习册系列答案
相关题目