��Ŀ����
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ
(i)I2(g)+H2(g)![]() 2HI(g) ��H= - 9.48kJ/mol
2HI(g) ��H= - 9.48kJ/mol
(ii) I2(s)+H2(g)![]() 2HI(g) ��H= + 26.48kJ/mol�������ж���ȷ���� �� ��
2HI(g) ��H= + 26.48kJ/mol�������ж���ȷ���� �� ��
A��254gI2(g)��ͨ��2gH2(g)����Ӧ����9.48kJ
B��1mol��̬����1mol��̬���������������l7.00kJ
C����Ӧ(i)�IJ���ȷ�Ӧ(ii)�IJ����ȶ�
D����Ӧ(i)��1molI-I����1molH-H����Ҫ��������С�ڲ�2molH-I����Ҫ��������
���𰸡�D
��������
���������A���˷�Ӧ�ǿ��淴Ӧ��������ȫ���е��ף�������Ŀ��������ų��������ʴ���B���ڶ�����Ӧʽ��ȥ��һ����Ӧʽ�õ�I2(s)=I2(g) ��H=��35.96kJ��mol��1���ʴ���C�����ﶼ��HI���ȶ�����ͬ���ʴ���D����һ����Ӧ�Ƿ��ȷ�Ӧ���ϼ����յ�����С���γɼ��ų�������������ȷ��

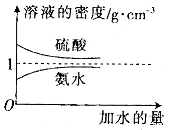
����Ŀ����֪���ᡢ��ˮ���ܶ�������ˮ���Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ��е���Ϣ���ش��������� ��
���ʵ����ʵ���Ũ��/ | ��Һ���ܶ�/ |
| |
���� |
|
| |
��ˮ |
|
|
��1�������������������Ϊ__________(��д��λ���ú�![]() ��
��![]() �Ĵ���ʽ��ʾ)��
�Ĵ���ʽ��ʾ)��
��2�����ʵ���Ũ��Ϊ![]()
![]() ��������ˮ��������(��Ϻ���Һ����仯���Բ���)��������Һ�����ʵ���Ũ��Ϊ___________
��������ˮ��������(��Ϻ���Һ����仯���Բ���)��������Һ�����ʵ���Ũ��Ϊ___________![]() ��
��
��3�����ʵ���Ũ��Ϊ![]()
![]() �İ�ˮ��
�İ�ˮ��![]()
![]()
![]() �İ�ˮ��������ϣ�������Һ���ܶ�______(��
�İ�ˮ��������ϣ�������Һ���ܶ�______(��
������������С������������������ͬ) ![]()
![]() ��������Һ�����ʵ���Ũ��________
��������Һ�����ʵ���Ũ��________![]()
![]()
![]()
(���Ϻ���Һ������仯���Բ���)
��4������ϡ�����백ˮ��ϣ�д���䷴Ӧ�����ӷ���ʽ___________________________.