题目内容
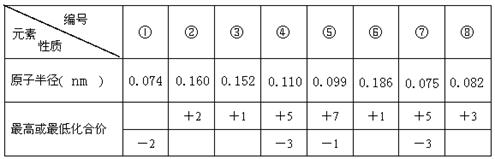
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型A、B、C三种元素以原子个数比4∶2∶3形成化合物有 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(5)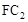 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出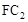 与氧气和水蒸气反应的化学方程式 。
与氧气和水蒸气反应的化学方程式 。
请回答下列问题:
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型A、B、C三种元素以原子个数比4∶2∶3形成化合物有 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(5)
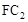 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出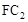 与氧气和水蒸气反应的化学方程式 。
与氧气和水蒸气反应的化学方程式 。(1)第3周期I A族(2分)
(2) >
> >
> (2分)
(2分)
(3)离子键、共价键(2分)
(4)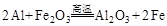 (2分)
(2分) (2分)
(2分)
(5)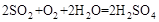 (2分,其他合理答案同样给分)
(2分,其他合理答案同样给分)
(2)
 >
> >
> (2分)
(2分)(3)离子键、共价键(2分)
(4)
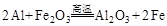 (2分)
(2分) (2分)
(2分)(5)
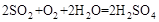 (2分,其他合理答案同样给分)
(2分,其他合理答案同样给分)试题分析:由题意可先推算出C为O2,D为Na,则F为S,A为H2,B为N2,E为Mg、Al、Si都有可能(视题而定)。
(1)D为Na,则其在元素周期表中的位置为:第3周期I A族;
(2)C、D、F三种元素形成的简单离子为:
 、
、 、
、 ,同一周期内元素的微粒,阴离子半径大于阳离子半径,则原子半径大小为:
,同一周期内元素的微粒,阴离子半径大于阳离子半径,则原子半径大小为: >
> >
> ;
;(3)A、B、C三种元素以原子个数比4∶2∶3形成化合物为:NH4NO3,A、B、C三种元素以原子个数比4∶2∶3形成化合物有:离子键、共价键;
(4)E是金属元素,其单质又能与氧化铁反应常用于焊接钢轨,故E为Al,则反应的化学方程式:
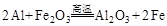 ,若E是非金属元素,其单质在电子工业中有重要应用,故E可为:Si,其氧化物溶于强碱溶液的离子方程式:
,若E是非金属元素,其单质在电子工业中有重要应用,故E可为:Si,其氧化物溶于强碱溶液的离子方程式: .
.(5)
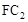 气体有毒,排放到大气中易形成酸雨,则
气体有毒,排放到大气中易形成酸雨,则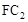 为SO2,SO2与氧气和水蒸气反应的化学方程式为:
为SO2,SO2与氧气和水蒸气反应的化学方程式为: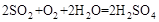
点评:对元素周期表中元素位置的确定,属于高考中基础内容的考查,本题解答的关键在于明确各元素的相关位置以及与其相邻的元素的原子序数关系。同时,考生应当全面系统的掌握原子周期律、化学键、化学方应方程式书写等内容,拓展学生的知识面。

练习册系列答案
相关题目