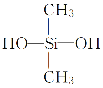
题目内容
【题目】Ni2+在氨性溶液中和镍试剂(丁二酮肟)反应生成鲜红色的螯合物沉淀,在定性分析中用于鉴定![]() 。该反应可表示为
。该反应可表示为

(1)Ni在元素周期表中的位置是_______,其基态原子的未成对电子数是_______。
(2)与Ni同周期,基态原子最外层电子数为1的元素有________(填元素符号)。其中原子序数最大的元素,其基态原子核外电子排布不符合________(填选项字母)。
A.构造原理 B.泡利不相容原理 C.洪特规则
(3)已知丁二酮肟(物质A)通常情况下是白色粉末,熔点238~240℃,溶于乙醇、乙醚,几乎不溶于水。则丁二酮肟的晶体类型是________。
(4)丁二酮肟的组成元素电负性由大到小的顺序是________。
(5)物质B中含有的微粒间作用力类型有________。
A.离子键 B.共价键 C.氢键 D.配位键
(6)物质B中C原子的杂化方式是________。
(7)氧化镍(NiO)的晶体结构为立方晶系,其晶胞结构与氯化钠相似。氧化镍晶胞中,与一个Ni2+紧邻且距离相等的O2-以线段相连,构成的几何图形为________。
(8)某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代,晶体仍显电中性。实验测得该氧化镍晶体的化学式为Ni0.90O,其晶胞参数为acm,NA代表阿伏加德罗常数的值,则该晶体的密度为________(用含a和NA的代数式表示)。
【答案】第四周期第Ⅷ族 2 K、Cr、Cu A 分子晶体 O>N>C>H BCD sp2、sp3 正八面体 ![]()
【解析】
(1)根据原子核外电子排布判断元素在周期表的位置及核外未成对电子数目;
(2)根据原子核外电子排布判断基态原子最外层电子数为1的元素,结合原子核外各个轨道为全满、半满、全空是稳定状态判断;
(3)根据物质的溶解性及熔沸点比较低的特点判断晶体类型;
(4)元素的非金属性越强,电负性越大;
(5)根据物质B结构判断化学键类型;
(6)根据价层电子对理论判断物质B中碳原子的杂化类型;
(7)根据NaCl晶体结构分析判断;
(8)参考NaCl的晶胞的结构,根据Ni0.90O计算晶胞密度。
(1)Ni是28号元素,电子排布式为1s22s22p63s23p63d84s2,结合原子结构与元素在周期表的位置关系可知:Ni位于元素周期表的第四周期第Ⅷ族;在3d轨道上有2个未成对电子;
(2)Ni是第四周期的元素,在第四周期中,19号元素为K,核外电子排布为2、8、8、1,最外层只有1个成单电子;24号元素为Cr,价电子排布式为3d54s1,最外层只有1个成单电子;29号元素为Cu,价电子排布式为3d104s1,最外层只有1个成单电子。所以位于第四周期基态原子最外层电子数为1的元素有K、Cr、Cu,其中铜元素基态原子核外电子排布不符合构造原理,合理选项是A;
(3)根据丁二酮肟(物质A)的性质,如熔点低,白色粉末以及溶解性可知,该物质在固态时为分子晶体;
(4)同一周期元素从左到右,元素的电负性逐渐增大,所以电负性由大到小的顺序为:O>N>C>H;
(5)在物质B中,Ni与N原子之间形成配位键,N-O、N-C原子之间形成共价键,N-O与H-O、H-O与H-O之间还形成了氢键,故合理选项是BCD;
(6)B中形成单键的碳原子的杂化方式为sp3,形成碳碳双键的碳原子的杂化方式为sp2杂化;
(7)NiO的晶胞与NaCl相似,所以NiO中O原子是面心立方最密堆积,Ni2+的配位数为6,形成的是正八面体;
(8)参考NaCl的晶胞的结构可知,该氧化镍晶体1个晶胞含有4个Ni0.90O,所以晶胞的质量为:![]() ,晶胞的密度
,晶胞的密度![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

【题目】现给你一试管二氧化氮,其他药品和仪器自选。
(1)设计实验,要求尽可能多地使二氧化氮被水吸收。某化学兴趣小组实验设计如下,请你帮他们将下表补充完整。
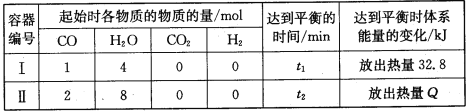
实验步骤 | 现象 | 化学方程式(解释) | |
① | 将一支充满NO2的试管倒放在盛有水的水槽中 | ___ | ___ |
② | 制取少量氧气 | ___ | |
③ | ___ | ___ | 4NO2+2H2O+O2=4HNO3 |
(2)完成上述实验的装置图如图,请你在方框内将它补充完整(加持装置可省略),需标明所用药品的名称___。

(3)以上设计让你对工业上生产硝酸有什么启示___?(从原料的充分利用、减少污染物的排放等方面考虑)。