题目内容
【题目】现给你一试管二氧化氮,其他药品和仪器自选。
(1)设计实验,要求尽可能多地使二氧化氮被水吸收。某化学兴趣小组实验设计如下,请你帮他们将下表补充完整。
实验步骤 | 现象 | 化学方程式(解释) | |
① | 将一支充满NO2的试管倒放在盛有水的水槽中 | ___ | ___ |
② | 制取少量氧气 | ___ | |
③ | ___ | ___ | 4NO2+2H2O+O2=4HNO3 |
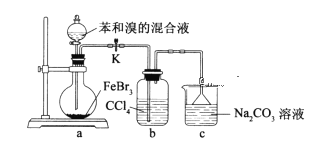
(2)完成上述实验的装置图如图,请你在方框内将它补充完整(加持装置可省略),需标明所用药品的名称___。

(3)以上设计让你对工业上生产硝酸有什么启示___?(从原料的充分利用、减少污染物的排放等方面考虑)。
【答案】红棕色气体逐渐消失,水位上升,最后水充满整个试管的![]() ,无色气体充满试管上部
,无色气体充满试管上部![]() 3NO2+H2O=2HNO3+NO 2KClO3
3NO2+H2O=2HNO3+NO 2KClO3![]() 2KCl+3O2↑或2H2O2
2KCl+3O2↑或2H2O2![]() 2H2O+O2↑, 将氧气慢慢地通入步骤①的试管中 无色气体变为红棕色气体,又变为无色气体,但气体体积逐渐缩小,液面不断上升最后充满整个试管
2H2O+O2↑, 将氧气慢慢地通入步骤①的试管中 无色气体变为红棕色气体,又变为无色气体,但气体体积逐渐缩小,液面不断上升最后充满整个试管 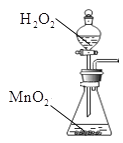 或
或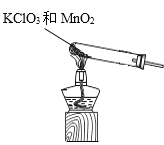 硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放)
硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放)
【解析】
(1)①二氧化氮与水的反应方程式为:3NO2+H2O=2HNO3+NO,进入试管中的液体体积占试管容积的![]() ,剩余
,剩余![]() 气体变为无色;
气体变为无色;
②实验室制取氧气是利用氯酸钾和二氧化锰固体混合加热反应生成氧气,或利用过氧化氢中加入二氧化锰催化剂反应生成氧气;
③液面不再上升时,通入氧气和一氧化氮反应生成红棕色的二氧化氮,二氧化氮溶于水又生成一氧化氮和硝酸,气体变为无色气体,液面上升,直至当试管充满液体,无气体剩余;
(2)方框内是制取氧气的装置;
(3) 工业上生产硝酸,主要反应为:4NH3+5O2![]() 4NO + 6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3。
4NO + 6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3。
(1)①尽可能多地使二氧化氮被水吸收,将一支充满NO2的试管倒放在盛有水的水槽中,NO2是红棕色气体,与水反应生成硝酸和一氧化氮,其反应方程式为:3NO2+H2O=2HNO3+NO,进入试管中的液体体积占试管容积的![]() ,剩余
,剩余![]() 气体变为无色,故答案为:红棕色气体逐渐消失,水位上升,最后水充满整个试管的
气体变为无色,故答案为:红棕色气体逐渐消失,水位上升,最后水充满整个试管的![]() ,无色气体充满试管上部
,无色气体充满试管上部![]() ;3NO2+H2O=2HNO3+NO;
;3NO2+H2O=2HNO3+NO;
②实验室制取氧气是利用氯酸钾和二氧化锰固体混合加热反应生成氧气,或利用过氧化氢中加入二氧化锰催化剂反应生成氧气,其化学反应方程式为:2KClO3![]() 2KCl+3O2↑或2H2O2
2KCl+3O2↑或2H2O2![]() 2H2O+O2↑,故答案为:2KClO3
2H2O+O2↑,故答案为:2KClO3![]() 2KCl+3O2↑或2H2O2
2KCl+3O2↑或2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③液面不再上升时,通入氧气和一氧化氮反应生成红棕色的二氧化氮,二氧化氮溶于水又生成一氧化氮和硝酸,气体变为无色气体,液面上升,直至当试管充满液体,无气体剩余,反应为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO或4NO2+2H2O+O2=4HNO3,故答案为:将氧气慢慢地通入步骤①的试管中;无色气体变为红棕色气体又变为无色气体,但气体体积逐渐缩小,液面不断上升最后充满整个试管;
(2)方框内是制取氧气的装置,利用氯酸钾和二氧化锰固体混合加热反应生成氧气的发生装置为: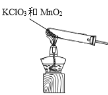 ,利用过氧化氢中加入二氧化锰催化剂反应生成氧气的发生装置为:
,利用过氧化氢中加入二氧化锰催化剂反应生成氧气的发生装置为: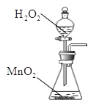 ,故答案为:
,故答案为: 或
或 ;
;
(3) 工业上生产硝酸,主要反应为:4NH3+5O2![]() 4NO + 6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3,硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放),故答案为:硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放)。
4NO + 6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3,硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放),故答案为:硝酸工业常在吸收反应进行过程中补充一些空气,使生成的NO再氧化为二氧化氮,从而尽可能地转化为硝酸(提高了原料的利用率,同时减少了污染性气体的排放)。

【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变