题目内容
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4,E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________ L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______________________________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是______________________________________________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:______________________________。
(1)HClO4 (2)4.48 (3)H2O2+H2S=S↓+2H2O (4)离子键、(极性)共价键 NaClO (5)HSO3—+H+=H2O+SO2↑ Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
解析

 阅读快车系列答案
阅读快车系列答案元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
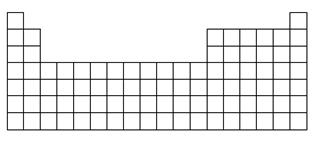
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为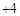 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。