题目内容
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为原子序数依次增大的同族元素。完成下列填空:
(1)铋在元素周期表中的位置是___。![]() Mc原子核内中子数与核外电子数之差为___。
Mc原子核内中子数与核外电子数之差为___。
(2)已知:P(s,红磷)![]() P(s,白磷)-17.6kJ;P(s,白磷)
P(s,白磷)-17.6kJ;P(s,白磷)![]() P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为___,其中最稳定的是___。
P(s,黑磷)+39.3kJ。红磷、白磷、黑鳞互为___,其中最稳定的是___。
(3)SbCl3能发生较强的水解:Sb3++Cl-+H2O![]() SbOCl↓+2H+。该水解反应的平衡常数表达式为____。配制SbCl3溶液应注意___。
SbOCl↓+2H+。该水解反应的平衡常数表达式为____。配制SbCl3溶液应注意___。
(4)写出能够比较磷与砷最高价氧化物对应水化物酸性强弱的一个实验事实___。
(5)科学家发明了用H2治理废水中硝酸盐的污染的方法,其原理可以表示为:5H2+2NO![]()
 N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO
N2+2OH-+4H2O。25℃时,反应进行10min,废水的pH由7变为12,这段时间内NO![]() 的平均反应速率为__。
的平均反应速率为__。
【答案】第六周期第VA族 58 同素异形体 黑磷 K=![]() 加入稀盐酸抑制水解 相同条件下,相同物质的量浓度的H3PO4溶液pH小于H3AsO4 0.001mol/(Lmin)
加入稀盐酸抑制水解 相同条件下,相同物质的量浓度的H3PO4溶液pH小于H3AsO4 0.001mol/(Lmin)
【解析】
(1)N为第二周期第VA族元素,则铋位于第六周期第VA族,![]() Mc的中子数=288-115=173,核外电子数=115,所以原子核内中子数与核外电子数之差=173-115=58,故答案为:第六周期第VA族;58;
Mc的中子数=288-115=173,核外电子数=115,所以原子核内中子数与核外电子数之差=173-115=58,故答案为:第六周期第VA族;58;
(2)红磷、白磷、黑鳞是由P元素组成的不同种单质,互为同素异形体。P(s,红磷)![]() P(s,白磷)-17.6kJ,则P(s,白磷)
P(s,白磷)-17.6kJ,则P(s,白磷)![]() P(s,红磷)+17.6kJ,1mol白磷转化为1mol红磷放出17.6kJ热量,P(s,白磷)
P(s,红磷)+17.6kJ,1mol白磷转化为1mol红磷放出17.6kJ热量,P(s,白磷)![]() P(s,黑磷)+39.3kJ,1mol白磷转化为1mol黑磷放出热量39.3kJ热量,说明三者的能量高低:1mol白磷>1mol红磷>1mol黑磷,黑磷最稳定,故答案为:同素异形体;黑磷;
P(s,黑磷)+39.3kJ,1mol白磷转化为1mol黑磷放出热量39.3kJ热量,说明三者的能量高低:1mol白磷>1mol红磷>1mol黑磷,黑磷最稳定,故答案为:同素异形体;黑磷;
(3)由平衡常数的定义可知,该反应的平衡常数K=![]() ,SbCl3能发生较强的水解:Sb3++Cl-+H2O
,SbCl3能发生较强的水解:Sb3++Cl-+H2O![]() SbOCl↓+2H+,配制SbCl3溶液时应加入H+抑制水解,为了不引入杂质,应加入HCl抑制水解,故配制SbCl3溶液时应加入稀盐酸抑制水解,故答案为:K=
SbOCl↓+2H+,配制SbCl3溶液时应加入H+抑制水解,为了不引入杂质,应加入HCl抑制水解,故配制SbCl3溶液时应加入稀盐酸抑制水解,故答案为:K=![]() ;加入稀盐酸抑制水解;
;加入稀盐酸抑制水解;
(4)同主族元素从上往下非金属性减弱,P的非金属性比As强,则H3PO4的酸性比H3AsO4强,可证明H3PO4的酸性比H3AsO4强的事实是:相同条件下,相同物质的量浓度的H3PO4溶液pH小于H3AsO4,故答案为:相同条件下,相同物质的量浓度的H3PO4溶液pH小于H3AsO4;
(5)pH=7时,c(OH-)=c(H+)=10-7mol/L,pH=12时,c(H+)=10-12,c(OH-)=![]() mol/L=10-2mol/L,
mol/L=10-2mol/L,![]() ≈10-2mol/L,结合反应的计量数可知:
≈10-2mol/L,结合反应的计量数可知:![]() ,所以v(NO3-)=
,所以v(NO3-)=![]() =0.001mol/(Lmin),故答案为:0.001mol/(Lmin)。
=0.001mol/(Lmin),故答案为:0.001mol/(Lmin)。

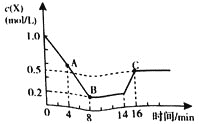
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )

实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快