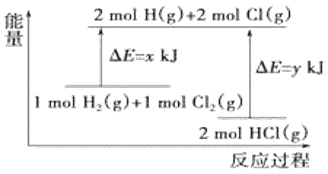
题目内容
【题目】A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。
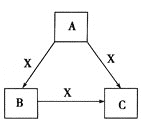
请针对以下三种不同情况回答:
![]() 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
![]() 中含有的金属元素在元素周期表中的位置为_______________________,向水中加入X物质,X对水的电离平衡的影响是_________
中含有的金属元素在元素周期表中的位置为_______________________,向水中加入X物质,X对水的电离平衡的影响是_________![]() 填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响”![]() 。
。
![]() 与C的水溶液混合后生成B,反应的离子方程式为___________________________。
与C的水溶液混合后生成B,反应的离子方程式为___________________________。
![]() 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成![]() 和
和![]() 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
![]() 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为![]() ,则
,则![]() 单质中含共价键数目为_________
单质中含共价键数目为_________![]() ,B的电子式为_________。
,B的电子式为_________。
![]() 与水反应的离子方程式为_______________________________________________。
与水反应的离子方程式为_______________________________________________。
![]() 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
![]() 中所含有的化学键类型是_________。
中所含有的化学键类型是_________。
![]() 溶液中离子浓度由小到大的顺序是_________。
溶液中离子浓度由小到大的顺序是_________。
【答案】第三周期第ⅢA族 抑制 ![]()
![]()
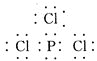
![]() 离子键、共价键
离子键、共价键 ![]()
【解析】
A、B、C、X是中学化学常见物质,均由短周期元素组成;
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al;加入X为氢氧化钠,抑制水的电离程度;
②A与C的水溶液混合后生成B,是铝离子和偏铝酸根离子双水解反应生成氢氧化铝沉淀;
(2)①若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气;依据磷单质分子式为P4分析共价键数,三氯化磷是共价化合物,写出电子式;
②X与水反应是氯气和水反应生成盐酸和次氯酸,次氯酸是弱电解质;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
①A为氢氧化钠使钠离子和氢氧根离子构成,据此分析化学键类型;
②C为NaHCO3,碳酸氢根离子水解大于电离,溶液呈碱性。
![]() 若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠。
若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠。
![]() 、B、C中含有的同一种常见金属元素为Al,在周期表中位置是第三周期,ⅢA族,向水中加入X氢氧化钠是碱,对水的电离平衡的影响是抑制;
、B、C中含有的同一种常见金属元素为Al,在周期表中位置是第三周期,ⅢA族,向水中加入X氢氧化钠是碱,对水的电离平衡的影响是抑制;
![]() 的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,反应离子方程式为
的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,反应离子方程式为![]() ;
;
![]() 若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为
若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为![]() 结构,由转化关系可知,A为白磷,B为三氯化磷,C为五氯化磷,x为氯气;
结构,由转化关系可知,A为白磷,B为三氯化磷,C为五氯化磷,x为氯气;
![]() 是白磷,是正四面体结构,所以1molA单质中含共价键数目为6NA;B为三氯化磷,各原子都满足8电子稳定结构,三氯化磷B的电子式为
是白磷,是正四面体结构,所以1molA单质中含共价键数目为6NA;B为三氯化磷,各原子都满足8电子稳定结构,三氯化磷B的电子式为![]() ;
;
![]() 为
为![]() ,与水反应,生成次氯酸和盐酸,反应的离子方程式为:
,与水反应,生成次氯酸和盐酸,反应的离子方程式为:![]() ;
;
![]() 若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
![]() 为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键;
为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键;
![]() 为
为![]() ,溶液中碳酸氢根离子水解大于电离,溶液呈碱性,溶液中离子浓度由小到大的顺序是:
,溶液中碳酸氢根离子水解大于电离,溶液呈碱性,溶液中离子浓度由小到大的顺序是:![]() 。
。

【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含______(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________(填“上方”或“下方”)。BaCl2溶液的浓度为______________ molL-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。