题目内容
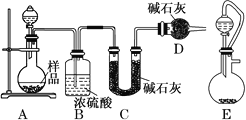
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
【答案】D
【解析】
A、硫化氢与浓硝酸发生氧化还原生成单质硫;B、试管内壁上有黄霜生成说明硝酸有氧化性和挥发性;C、硫化氢、挥发出的硝酸及硫化氢与硝酸发生氧化还原反应生成氮的氧化物对环境造成污染;D、浓盐酸不具有强氧化性。
A、硫化氢与浓硝酸发生氧化还原生成单质硫,所以试管内壁上“黄霜”的成分是硫,正确;B、试管内壁上有黄霜生成说明硝酸有氧化性和挥发性,所以浓硝酸既有氧化性,又有挥发,正确;C、烧杯内氢氧化钠溶液能够吸收过量的硫化氢、挥发出的硝酸以及硫化氢与硝酸发生氧化还原反应生成氮的氧化物,防止尾气污染环境,所以烧杯内的NaOH溶液的作用是除去尾气,正确;D、硫化氢不能与浓盐酸发生氧化还原反应,不能用浓盐酸代替,错误。
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D