题目内容
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
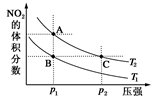
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深、C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深、C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
C
试题分析:反应N2O4(g)
 2NO2(g) ΔH=+57 kJ·mol-1为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答即可。A、由图象可知,A、C两点都在等温线上,C点的压强大。压强大,反应速率快,则A、C两点的反应速率:A<C,故A错误;B、A、C两点都在等温线上,但压强不同。C点压强,增大压强平衡向逆反应方向移动,NO2的浓度增大。NO2为红棕色气体,浓度越大,颜色越深,所以由图象可知A、C两点气体的颜色:A钱,C深,故B不正确;C、正方应是吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大。由图象可知,A点NO2的体积分数大于B点,则由状态B到状态A,可以用加热的方法,故C正确;D、由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,气体的质量不变,则平均相对分子质量大,即平均相对分子质量是A<C,故D错误,答案选C。
2NO2(g) ΔH=+57 kJ·mol-1为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答即可。A、由图象可知,A、C两点都在等温线上,C点的压强大。压强大,反应速率快,则A、C两点的反应速率:A<C,故A错误;B、A、C两点都在等温线上,但压强不同。C点压强,增大压强平衡向逆反应方向移动,NO2的浓度增大。NO2为红棕色气体,浓度越大,颜色越深,所以由图象可知A、C两点气体的颜色:A钱,C深,故B不正确;C、正方应是吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大。由图象可知,A点NO2的体积分数大于B点,则由状态B到状态A,可以用加热的方法,故C正确;D、由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,气体的质量不变,则平均相对分子质量大,即平均相对分子质量是A<C,故D错误,答案选C。
练习册系列答案
相关题目
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求: 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: 2NH3(g) △H<0平衡向逆反应方向移动的是
2NH3(g) △H<0平衡向逆反应方向移动的是 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到 2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( ) 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是 [N(CH3)4]2S2O6(s)ΔH<0 则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为
[N(CH3)4]2S2O6(s)ΔH<0 则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为