题目内容
改变下列条件,能使N2(g)+3H2(g)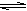 2NH3(g) △H<0平衡向逆反应方向移动的是
2NH3(g) △H<0平衡向逆反应方向移动的是
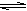 2NH3(g) △H<0平衡向逆反应方向移动的是
2NH3(g) △H<0平衡向逆反应方向移动的是| A.升高温度 | B.增大压强 | C.增大H2的浓度 | D.使用催化剂 |
A
试题分析:反应N2(g)+3H2(g)
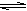 2NH3(g) △H<0的正反应是应该气体体积碱性的放热反应。A.根据平衡移动原理,升高温度化学平衡向吸热反应方向即逆反应方向移动。正确。B.根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向就是正反应方向移动。错误。C.根据平衡移动原理,增大反应物H2的浓度,化学平衡向正反应方向移动。错误。D.使用催化剂,能改变化学反应速率,但对于化学平衡的移动无影响。错误。
2NH3(g) △H<0的正反应是应该气体体积碱性的放热反应。A.根据平衡移动原理,升高温度化学平衡向吸热反应方向即逆反应方向移动。正确。B.根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向就是正反应方向移动。错误。C.根据平衡移动原理,增大反应物H2的浓度,化学平衡向正反应方向移动。错误。D.使用催化剂,能改变化学反应速率,但对于化学平衡的移动无影响。错误。
练习册系列答案
相关题目

 P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应
P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应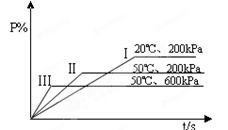
 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是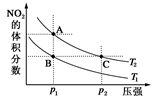
 CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: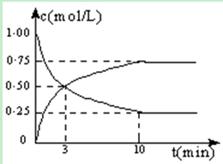
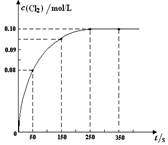
 PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )