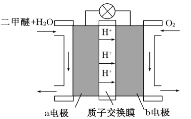
题目内容
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
【答案】B
【解析】
氧化剂发生还原反应,元素化合价降低。
A. NaOH+HCl=NaCl+H2O,反应为复分解反应,未发生化合价变化,A错误;
B. Zn+2HCl=ZnCl2+H2↑,氢离子体现氧化性,化合价降低,HCl作氧化剂,B正确;
C. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,氯离子体现还原性,化合价升高,HCl作还原剂,C错误;
MnCl2+2H2O+Cl2↑,氯离子体现还原性,化合价升高,HCl作还原剂,C错误;
D. CuO+2HCl=CuCl2+H2O,无元素化合价变化,D错误;
故答案选B。

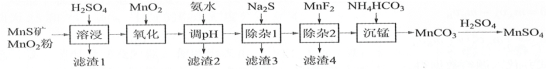
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D