题目内容
(15分)图1是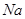 、
、 、
、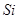 、
、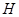 、
、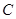 、
、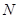 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含 个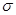 键, 个
键, 个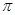 键。
键。
(3)a与b的元素形成的10个电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为 ,其中X与d 高价离子之间以 键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
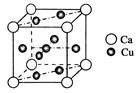
(5)图中C单质的晶体堆积方式类型是 ,这种堆积方式晶胞中原子的配位数为 。
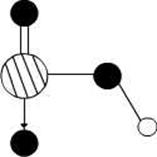
图1 图2
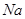 、
、 、
、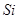 、
、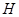 、
、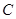 、
、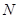 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是 (2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含 个
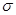 键, 个
键, 个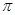 键。
键。(3)a与b的元素形成的10个电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为 ,其中X与d 高价离子之间以 键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
(5)图中C单质的晶体堆积方式类型是 ,这种堆积方式晶胞中原子的配位数为 。


图1 图2
(1) (2分)
(2分)
(2)2 2 (4分)
(3)三角锥 配位(3分)
(4)硝酸分子是极性分子,易溶于极性溶剂的水中 硝酸分子中氢氧键易与水分子间形成氢键(2分)(5)体心立方堆积 8(4分)
 (2分)
(2分)(2)2 2 (4分)
(3)三角锥 配位(3分)
(4)硝酸分子是极性分子,易溶于极性溶剂的水中 硝酸分子中氢氧键易与水分子间形成氢键(2分)(5)体心立方堆积 8(4分)
(1)c、d均是热和电的良导体。且d的熔点高于c的,所以c是钠,d是铜,根据构造原理可知电子排布为 。
。
(2)根据熔点高低可判断,a是氢气,b是氮气,e是硅,f是金刚石。a、b、f对应的元素以原子个数比1:1:1形成的分子是HCN,其中氢和碳是单键,碳和氮是三键,所以含有的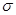 键是2个,
键是2个, 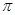 键也是2个。
键也是2个。
(3)a与b的元素形成的10个电子中性分子X是氨气,属于三角锥形。氨气和铜离子可形成配位键,离子的化学式为[Cu(NH3)4]2+。
(4)根据结构模型可判断,化合物是硝酸,硝酸属于极性分子,易溶在极性溶剂中,且硝酸中存在氢键。
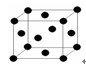
(5)金属钠的晶体堆积方式体心立方堆积,配位数是8.
 。
。(2)根据熔点高低可判断,a是氢气,b是氮气,e是硅,f是金刚石。a、b、f对应的元素以原子个数比1:1:1形成的分子是HCN,其中氢和碳是单键,碳和氮是三键,所以含有的
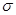 键是2个,
键是2个, 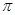 键也是2个。
键也是2个。(3)a与b的元素形成的10个电子中性分子X是氨气,属于三角锥形。氨气和铜离子可形成配位键,离子的化学式为[Cu(NH3)4]2+。
(4)根据结构模型可判断,化合物是硝酸,硝酸属于极性分子,易溶在极性溶剂中,且硝酸中存在氢键。
(5)金属钠的晶体堆积方式体心立方堆积,配位数是8.

练习册系列答案
相关题目