题目内容
(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
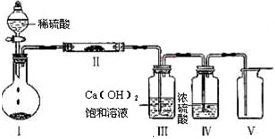
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO40.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO410 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
Ⅰ.(1)黄绿色 (1分)
(2)2 NaCl +2 H2OH2↑+ Cl2↑ + 2NaOH (2分,答案合理均给分)
(3)3 Cl2 + I— +3 H2O == 6 Cl- + IO3— + 6 H+(2分)
Ⅱ.
(1)H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象。(2分)
(2)①液体呈浅蓝色,(2分)溶液中含有Cu2+ 。(2分)
②有白色固体在试管底部析出,(2分)
98%浓H2SO4有吸水性,生成无水CuSO4。(2分)
解析:

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案




 X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答:
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答: