题目内容
【题目】某学生用0.10mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂。重复上述滴定操作2~3 次,记录数据如下。
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用待测盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数 ,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50 mL,所得溶液的pH为 。
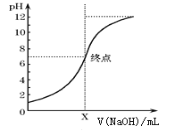
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图像,当滴加NaOH溶液为10mL时,该混合液的pH= ,(含lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 。
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
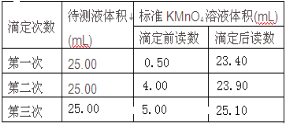
①滴定时,滴定终点时滴定现象是_____________。
②该草酸溶液的物质的量浓度为_____________。
【答案】
(1)ADF
(2)10
(3)pH=1+lg3 D
(4)①锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色; ②0.2 mol/L
【解析】
试题分析:
(1)根据c(待测)= ![]() 可知,c(待测)与V(标准)为正比关系,当V(标准)偏大,c(待测)偏高,当V(标准)偏小,c(待测)偏低。A、滴定终点读数时仰视读数,导致消耗标准液的体积读数偏大,可知测定结果偏高,故A正确;B、锥形瓶水洗后可以直接使用,没干燥也不影响,但若用待测盐酸润洗,则会造成标准液的体积偏大,结果偏高,所以未用待测盐酸润洗,滴定时对标准液的体积没有影响,可知测定结果不变,故B错误;C、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,导致待测液浓度减小,消耗的标准液体积减小,可知测定结果偏低,故C错误;D、标准液漏滴在锥形瓶外一滴,导致消耗标准液的体积偏大,可知测定结果偏高,故D正确;E.滴定前仰视读数 ,终点滴定后俯视读数,导致消耗标准液的体积读数偏小,可知测定结果偏低,故E错误;F.碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗的标准液体积读数偏大,可知测定结果偏高,故F正确;故选ADF。
可知,c(待测)与V(标准)为正比关系,当V(标准)偏大,c(待测)偏高,当V(标准)偏小,c(待测)偏低。A、滴定终点读数时仰视读数,导致消耗标准液的体积读数偏大,可知测定结果偏高,故A正确;B、锥形瓶水洗后可以直接使用,没干燥也不影响,但若用待测盐酸润洗,则会造成标准液的体积偏大,结果偏高,所以未用待测盐酸润洗,滴定时对标准液的体积没有影响,可知测定结果不变,故B错误;C、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,导致待测液浓度减小,消耗的标准液体积减小,可知测定结果偏低,故C错误;D、标准液漏滴在锥形瓶外一滴,导致消耗标准液的体积偏大,可知测定结果偏高,故D正确;E.滴定前仰视读数 ,终点滴定后俯视读数,导致消耗标准液的体积读数偏小,可知测定结果偏低,故E错误;F.碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗的标准液体积读数偏大,可知测定结果偏高,故F正确;故选ADF。
(2)多加一滴NaOH溶液后继续加水到50 mL,所得溶液的c(OH-)=(0.1mol/L×0.05mL)÷50 mL=1×10-4 mol·L-1,pH=10。
(3)由溶液的pH变化图像起点可知,当还没加入NaOH溶液时,此时pH=1,则c(HCl)=0.1mol/L。当滴加NaOH溶液为10mL时,盐酸没反应完,此时溶液中c(H+)= ![]() =
=![]() ,该混合液的pH=1+lg3。若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,生成CH3COONa,因为水解溶液呈碱性,所以只能选用酚酞作指示剂,故选D。
,该混合液的pH=1+lg3。若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,生成CH3COONa,因为水解溶液呈碱性,所以只能选用酚酞作指示剂,故选D。
(4)①高锰酸钾溶液为标准溶液滴定草酸时,根据反应可知,当草酸全部被消耗时,高锰酸钾过量,溶液变红,所以滴定终点时滴定现象是锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色;②第一次消耗高锰酸钾体积为22.90mL,第二次消耗高锰酸钾体积为19.90mL,第一次消耗高锰酸钾体积为20.10mL,所以第一次误差较大,舍去。则两次反应消耗高锰酸钾体积的平均值为20.00mL。则草酸溶液的物质的量浓度为(0.1mol/L×20.00mL×![]() )÷25.00mL=0.2mol/L。
)÷25.00mL=0.2mol/L。