题目内容
【题目】Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H="-a" kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H ="-b" kJ·mol-1;CO的燃烧热△H ="-c" kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
【答案】(每空2分共18分)
Ⅰ.(1)>;<;
(2)0.008mol/(L.min);40%;
(3)18.3;
(4)否;>;
Ⅱ.(1)>;
(2)4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H="-a+b-2c" kJmol-1。
【解析】试题分析:Ⅰ.(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数关系K1>K2,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0,故答案为:>;<;
(2)将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以![]() =25%,解得n=0.4,故v(N2)=
=25%,解得n=0.4,故v(N2)=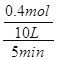 =0.008mol/(L.min),
=0.008mol/(L.min),
N2的转化率=![]() ×100%=40%,故答案为:0.008mol/(L.min);40%;
×100%=40%,故答案为:0.008mol/(L.min);40%;
(3)T1温度下该反应的化学平衡常数K1=![]() =
=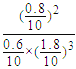 ≈18.3,故答案为:18.3;
≈18.3,故答案为:18.3;
(4)此时浓度商Qc=![]() =4<K=18.3,未处于平衡状态,反应向正反应进行,则v正>v逆,故答案为:否;>;
=4<K=18.3,未处于平衡状态,反应向正反应进行,则v正>v逆,故答案为:否;>;
Ⅱ.(1)反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,气体物质的量增加熵增,故答案为:>;
(2)因为①2CO(g)+2NO(g)═N2(g)+2CO2(g)△H="-a" kJmol-1;
②2NO(g)+O2(g)═2NO2(g) △H="-b" kJmol-1;CO的燃烧热△H="-c" kJmol-1,即:③CO(g)+![]() O2(g)=CO2(g)△H=-ckJ/mol,根据盖斯定律可知,
O2(g)=CO2(g)△H=-ckJ/mol,根据盖斯定律可知,
目标反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)为①-②+2×③,
所以4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H="-a+b-2c" kJmol-1.
故答案为:4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H="-a+b-2c" kJmol-1。

 名校课堂系列答案
名校课堂系列答案