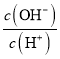题目内容
【题目】现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() _______(填“增大”“减小”或“不变”)。
_______(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式_____________;若所得溶液的pH=5,则溶液中由水所电离出的氢离子浓度为___________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=______。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是_____________________________________________。
【答案】 减小 NH3·H2O+H+=NH4++H2O 10-5mol/L a/2 mol·L-1 c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【解析】现有25 ℃时0.1 mol/L的氨水,溶液中存在电离平衡NH3H2O![]() NH4++OH- 。
NH4++OH- 。
(1)若向氨水中加入少量硫酸铵固体,可以增大氨水中铵根的浓度,所以氨水的电离平衡逆向移动,此时溶液中![]() 减小;
减小;
(2)向氨水中加入稀硫酸使其恰好中和得到硫酸铵溶液,反应的离子方程式NH3·H2O+H+===NH![]() +H2O;硫酸铵水解使溶液呈酸性,溶液中的H+全部来自于水,所以若所得溶液的pH=5,则溶液中由水所电离出的氢离子浓度为10-5mol/L。
+H2O;硫酸铵水解使溶液呈酸性,溶液中的H+全部来自于水,所以若所得溶液的pH=5,则溶液中由水所电离出的氢离子浓度为10-5mol/L。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH![]() )=a mol/L,由电荷守恒得则c(SO
)=a mol/L,由电荷守恒得则c(SO![]() )=
)=![]() c(NH
c(NH![]() )=
)=![]() mol/L;
mol/L;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则两溶液改好完全反应得到硫酸铵溶液,铵根水解使溶液呈酸性,所以,所得溶液中各离子物质的量浓度由大到小的关系是c(NH4+)>c(SO42-)>c(H+)>c(OH-)。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3* | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时 的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时 的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需__________________________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏小的操作是____________________(填序号)
a.定容时俯视刻度线 b.量取浓硫酸时,俯视刻度线
c.当容置瓶中液体占容积2/3左右时,未振荡摇匀 d.转移溶液时,没有等溶液冷却至室温
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是_____________________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平)
____________________________________________________________Na2SO4.