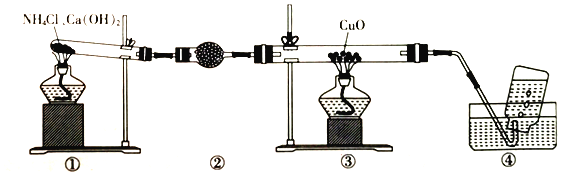
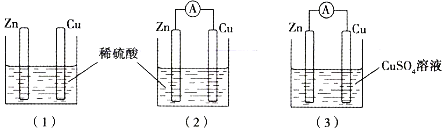
题目内容
【题目】在4mol/L的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,则①原混合酸中c( H+)为________________。
②溶液中发生反应的离子方程式为_______。
③充分反应后最多可收集到标准状况下的气体的体积为__________,被还原硝酸的物质的量为_____________________________。
【答案】10mol/L 3Cu+8H++2NO3-=2NO↑+4H2O+3Cu2+ 224mL 0.01mol
【解析】
①原混合酸中c( H+)为4mol/L×2+2mol/L=10mol/L;
②铜与溶液中的氢离子和硝酸根离子反应生成铜离子、一氧化氮和水,故溶液中发生反应的离子方程式为3Cu+8H++2NO3-=2NO↑+4H2O+3Cu2+;
③n(Cu)=![]() ,n(H+)=10mol/L×0.01L=0.1mol,
,n(H+)=10mol/L×0.01L=0.1mol,
3Cu + 8H+ + 2NO3- = 2NO↑ +4H2O+3Cu2+
3mol 8mol 2mol 44.8L
0.015mol 0.1mol 0.02mol V
铜不足以铜的量求V, V=0.224L=224mL;
充分反应后最多可收集到标准状况下的气体的体积为224mL,被还原硝酸的物质的量为![]() 。
。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
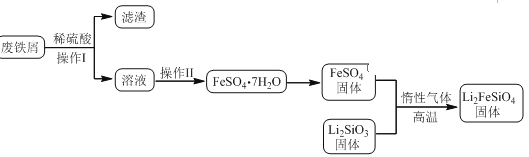
实验(二)Li2FeSiO4含量测定:
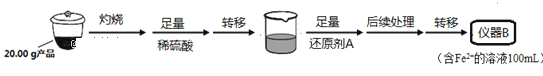
从仪器B中取20.00mL溶液至锥形瓶中,另取0.20molL-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B____,仪器C____。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____;
(4)操作Ⅱ的步骤是:__、__、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____,此时后续处理的主要目的是____。
(6)滴定终点时现象为____;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____(填“偏高”、“偏低”或“不变”)。