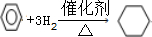
题目内容
8.短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为32,且原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为单键相连 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
分析 短周期元素A、B、C、D的原子序数依次递增,B与D均为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,则B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素,以此解答该题.
解答 解:短周期元素A、B、C、D的原子序数依次递增,B与D均为同主族元素,B的原子序数大于A,故B处于第二周期,D处于第三周期,A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,四元素原子最外层电子数之和为10,故B、D的最外层电子数为$\frac{10-1-1}{2}$=4,故B、D处于ⅣA族,则B为碳元素,D为Si元素,C元素原子序数大于碳元素,故C为Na元素,四元素原子序数之和为32,故A元素的原子序数为32-14-6-11=1,则A为H元素.
A.D为Si元素,处于周期表中第三周期ⅣA族,故A错误;
B.在同一周期从左到右原子半径逐渐减小,同主族自上而下原子半径中等,所有元素中H原子半径最小,则半径关系为A(H)<B(碳)<D(Si)<C(Na),故B错误;
C.B、D的最高价氧化物分别为CO2、SiO2,CO2存在C=O双键,故C错误;
D.存在反应:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,2Na+2H2O=2NaOH+H2↑,故D正确,
故选D.
点评 本题考查位置结构性质关系综合应用,关键是根据原子序数及B、D同主族明确元素B为第二周期元素,题目难度不大.

①NaHCO3 ②(NH4)2S ③Al(OH)3 ④NH4Cl ⑤H2N-CH2-COOH ⑥CH3COOH.
| A. | ①②③ | B. | ①②④⑤ | C. | ⑤⑥ | D. | ①②③⑤ |
| A. | 有单质参加的反应,置换反应一定都属于氧化还原反应 | |
| B. | 简单非金属阴离子只有还原性,而金属阳离子只有氧化性 | |
| C. | 离子化合物在熔融态都能够导电,共价化合物在熔融态都不导电 | |
| D. | 所有物质都有化学键 |
| A. | 甘油 | B. | 醋酸 | C. | 甲醇 | D. | 乙醛 |
| A. | △H>0,△S<0 | B. | △H<0,△S>0 | C. | △H>0,△S>0 | D. | △H<0,△S<0 |
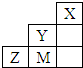
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |