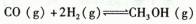题目内容
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )
 xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( ) | A.A的平均反应速率为0.15 mol?L-1?min-1 |
| B.平衡时,C的浓度为0.25mol?L-1 |
| C.B的平均反应速率为0.1 mol?L-1?min-1 |
| D.平衡时,容器内压强为原来的0.875倍 |
C
试题分析:A.V(A):V(D)="3:1." V(D)=" 0.05mol/(" L?min),所以V(A)=" 0.15mol/(" L?min).正确。B.由于反应是在恒容的密闭容器内进行,达到平衡容器内压强变小,所以3>x+1.因此x="1." V(C):V(D)=1:1,故V(C)=" 0.05mol/(" L?min)。c(C)=" 0.05mol/(" L?min)×5min=0.25mol/L。正确。C. 由于B物质的状态为固态,所以其浓度不会发生变化,因此不能用物质间的速率关系来表示。错误。 D.平衡时,容器内压强与开始时的压强比为容器内气体的物质的量的比。在开始时n(A)=4mol;当达到平衡时n(C)=n(D)= 0.05mol/( L?min)×2L×5min="0." 5mol.则n(A)=4mol-3×0. 5mol="2." 5mol.所以平衡时容器内气体的总物质的量为:2. 5mol+0.5mol+0.5mol="3." 5mol。故压强为原来的3. 5mol÷4mol="0.875." 故平衡时,容器内压强为原来的0.875倍。正确。

练习册系列答案
相关题目
 H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为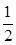 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。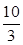 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
 N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是