��Ŀ����
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裬��֪
SO2��g����
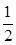 O2��g��
O2��g�� SO3��g����H����98 kJ��mol��1��
SO3��g����H����98 kJ��mol��1����1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��
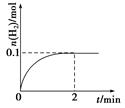
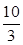 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 molSO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv�� v�������������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
A�����¶Ⱥ�����������䣬����1.0 mol O2
B�����¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�����¶�
D�ƶ�����ѹ������
��4��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬд��ͨ��O2�缫�ĵ缫��ӦʽΪ ��

��5��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ ��
��1����
��2��60%
��3��A��C
��4��O2��4e����4H+��2H2O
��5��16:29
��2��60%
��3��A��C
��4��O2��4e����4H+��2H2O
��5��16:29
��1����100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)���ɵ�K`=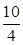 ��K`��K���ʷ�Ӧ������Ӧ�����ƶ�������Ӧ���ʣ��淴Ӧ���ʡ�
��K`��K���ʷ�Ӧ������Ӧ�����ƶ�������Ӧ���ʣ��淴Ӧ���ʡ�
��2������SO2��g����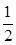 O2��g��
O2��g�� SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0
SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0
molO2���ﵽƽ��������Ϊ1.6 L����֪��Ӧ��ѹǿ��Ϊԭ����1.6L/2L=80%���ʷ�Ӧ��������ʵ���Ϊ��2+1����80%=2.4mol��
SO2��g����1/2O2��g�� SO3��g��
SO3��g��
��ʼ���ʵ��� 2mol 1mol 0mol
�仯���ʵ��� 2a a 2a
ƽ�����ʵ��� 2-2a 1-a 2a
��(2-2a)+(1-a)+2a="2.4mol" ��a=0.6mol������SO2��ת����Ϊ��2��0.6��mol/2mol��100%=60%
��3��A�м��뷴Ӧ����������Ӧ������Ӧ������У�SO2Ũ�Ƚ��͡�B�м���SO2����Ӧ������Ӧ������У���SO2ת���ʽ��ͣ�Ũ�����ߡ�C�и÷�ӦΪ���ȷ�Ӧ�������¶ȣ�������Ӧ������У�SO2Ũ�Ƚ��͡�D�л���ѹ�������ƽ��������Ӧ�����ƶ����������С��Ũ������ѡ��A��Cѡ�
��4��O2��4e����4H+��2H2O
��5���÷�Ӧ���ܷ�Ӧ����ʽӦΪ2SO2+O2+2H2O=2H2SO4�������SO2�����ʵ���Ϊa������H2O�����ʵ���Ϊb��������98a/[98a+18��b-a��] =0.5����a��b=9��58������ߵ�����֮��Ϊ16:29��
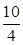 ��K`��K���ʷ�Ӧ������Ӧ�����ƶ�������Ӧ���ʣ��淴Ӧ���ʡ�
��K`��K���ʷ�Ӧ������Ӧ�����ƶ�������Ӧ���ʣ��淴Ӧ���ʡ���2������SO2��g����
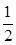 O2��g��
O2��g�� SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0
SO3��g�������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0molO2���ﵽƽ��������Ϊ1.6 L����֪��Ӧ��ѹǿ��Ϊԭ����1.6L/2L=80%���ʷ�Ӧ��������ʵ���Ϊ��2+1����80%=2.4mol��
SO2��g����1/2O2��g��
 SO3��g��
SO3��g����ʼ���ʵ��� 2mol 1mol 0mol
�仯���ʵ��� 2a a 2a
ƽ�����ʵ��� 2-2a 1-a 2a
��(2-2a)+(1-a)+2a="2.4mol" ��a=0.6mol������SO2��ת����Ϊ��2��0.6��mol/2mol��100%=60%
��3��A�м��뷴Ӧ����������Ӧ������Ӧ������У�SO2Ũ�Ƚ��͡�B�м���SO2����Ӧ������Ӧ������У���SO2ת���ʽ��ͣ�Ũ�����ߡ�C�и÷�ӦΪ���ȷ�Ӧ�������¶ȣ�������Ӧ������У�SO2Ũ�Ƚ��͡�D�л���ѹ�������ƽ��������Ӧ�����ƶ����������С��Ũ������ѡ��A��Cѡ�
��4��O2��4e����4H+��2H2O
��5���÷�Ӧ���ܷ�Ӧ����ʽӦΪ2SO2+O2+2H2O=2H2SO4�������SO2�����ʵ���Ϊa������H2O�����ʵ���Ϊb��������98a/[98a+18��b-a��] =0.5����a��b=9��58������ߵ�����֮��Ϊ16:29��

��ϰ��ϵ�д�
 ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
�����Ŀ


 ��
��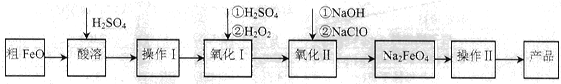

 4NH3(g)��3O2(g)��H��a kJ��mol��1
4NH3(g)��3O2(g)��H��a kJ��mol��1 2NH3(g)����H����92 .4 kJ��mol��1���ֱ��о���T1��T2��T3(T1<T2<T3)�����¶��ºϳɰ����Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��N2����ʼ��ɱ�(��ʼʱN2�����ʵ�����Ϊ1 mol)��N2ƽ��ת���ʵĹ�ϵ����ش�
2NH3(g)����H����92 .4 kJ��mol��1���ֱ��о���T1��T2��T3(T1<T2<T3)�����¶��ºϳɰ����Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��N2����ʼ��ɱ�(��ʼʱN2�����ʵ�����Ϊ1 mol)��N2ƽ��ת���ʵĹ�ϵ����ش�
 CO(g)��H2(g)��
CO(g)��H2(g)�� H2(g)��CO2(g)��
H2(g)��CO2(g)�� 2NH3(g)����H��0�����ѹǿ��ʱ��ͼ����ͼ�ף����p2��0.6p1����ʱ�¶�����ʼ�¶���ͬ���ڴﵽƽ��ǰijһʱ��(t1)�����ı�һ���������õ�����ͼ��
2NH3(g)����H��0�����ѹǿ��ʱ��ͼ����ͼ�ף����p2��0.6p1����ʱ�¶�����ʼ�¶���ͬ���ڴﵽƽ��ǰijһʱ��(t1)�����ı�һ���������õ�����ͼ��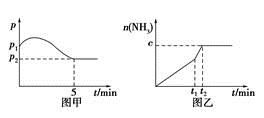
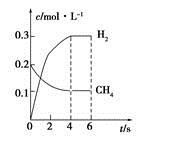
 CO(g)��3H2(g)�Ʊ�CO��H2����һ��������1 L���ܱ������г���0.3 mol H2O��0.2 mol CH4�����H2(g)��CH4(g)�����ʵ���Ũ����ʱ��仯��������ͼ��ʾ��0��4 s�ڣ���CO(g)��ʾ�ķ�Ӧ����Ϊ____________��
CO(g)��3H2(g)�Ʊ�CO��H2����һ��������1 L���ܱ������г���0.3 mol H2O��0.2 mol CH4�����H2(g)��CH4(g)�����ʵ���Ũ����ʱ��仯��������ͼ��ʾ��0��4 s�ڣ���CO(g)��ʾ�ķ�Ӧ����Ϊ____________��
 2NH3�ﵽ��ѧƽ��״̬������˵��һ����ȷ����
2NH3�ﵽ��ѧƽ��״̬������˵��һ����ȷ����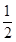
 xC(g)��D(g)��5min��Ӧ�ﵽƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.05mol?L-1?min-1 �����н��۴������( )
xC(g)��D(g)��5min��Ӧ�ﵽƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.05mol?L-1?min-1 �����н��۴������( )  H2����I2
H2����I2