题目内容
一定温度下,在溶剂为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应2 NO2(红棕色) N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:

(1)在该温度下,反应的化学平衡常数表达式为: 。
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol· L-1· s-1。
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: 。
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率。
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)。
 N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为: 。
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol· L-1· s-1。
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: 。
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率。
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)。
⑴K= ⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深
⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深
 ⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深
⑵0.1 ⑶t3 ⑷> ⑸正反应方向 ⑹变深试题分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此可逆反应2NO2
 N2O4的平衡常数表达式K=
N2O4的平衡常数表达式K= 。
。(2)由图可知,从t1至t2时N2O4的物质的量变化量为4mol-3mol=1mol,其浓度变化量为1mol/L,时间是20s-10s=10s,所以故v(N2O4)=1mol/L÷10s=0.1mol/(L?s)。
(3)到达平衡时,反应混合物各组分的物质的量不发生变化,由图象可知,t3时刻处于平衡状态,故答案为:t3。
(4)t1时刻后,NO2浓度降低,N2O4浓度增大,未到达平衡状态,反应向正反应进行,故正反应速率大于逆反应速率,故答案为:>。
(5)维持容器的温度不变,缩小容器的体积,压强增大,平衡向体积减小的方向移动,即向正反应方向移动,故答案为:正反应方向。
(6)维持容器的体积不变,升高温度,平衡向逆反应移动,NO2浓度增大,混合气体颜色变深,故答案为:变深。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 2H2↑+O2↑
2H2↑+O2↑ 2H2+O2
2H2+O2 2H2↑+O2↑
2H2↑+O2↑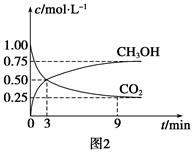
 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是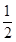

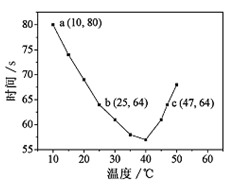
 xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )  CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )