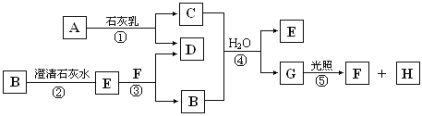
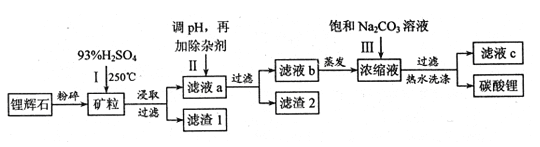
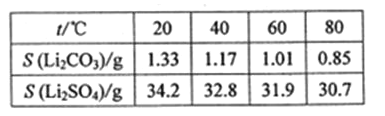
题目内容
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.168 mL C.224mL D.336 mL
【答案】D
【解析】
试题分析:将盛有此气休的容器倒扣在水中,通入标准状况下一定体积的氧气恰好使气体完全被水吸收生成硝酸,说明氮的氧化物又重新转化为硝酸,因此根据电子转移守恒可知,铜失去的电子最终被氧气获得,铜失去电子的物质的量是![]() =0.06mol,则氧气获得的电子也是0.06mol,所以氧气的物质的量是0.06mol÷4=0.015mol,则氧气的体积是0.015mol×22.4L/mol=0.336L=336ml,答案选D。
=0.06mol,则氧气获得的电子也是0.06mol,所以氧气的物质的量是0.06mol÷4=0.015mol,则氧气的体积是0.015mol×22.4L/mol=0.336L=336ml,答案选D。

练习册系列答案
相关题目