题目内容
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系(反应中生成的水已略去)。
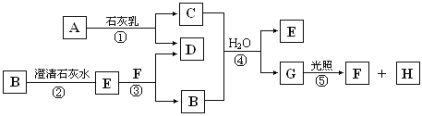
请回答以下问题:
(1)E是 (填化学式),G是 (填名称);
(2)C物质在日常生活中可作 ;
(3)写出反应①的化学方程式 ;
C与浓盐酸反应,可以生成A气体,写出反应的化学方程式 。
【答案】
(1)CaCO3 次氯酸
(2)消毒剂(或漂白剂)
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2+4HCl==CaCl2+2Cl2↑+2H2O
【解析】
试题分析:B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可知C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2。
(1)由以上分析可知E为CaCO3,G为HClO,故答案为:CaCO3,次氯酸;
(2)C为Ca(ClO)2,可生成HClO,具有强氧化性和漂白性,可用于消毒或漂白;
(3)反应①的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;C与浓盐酸反应,可以生成A气体,C为Ca(ClO)2 与浓盐酸反应生成Cl2的化学方程式为:Ca(ClO)2 + 4HCl== CaCl2 + 2Cl2↑+ 2H2O;

 53随堂测系列答案
53随堂测系列答案【题目】在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)![]() xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1

