题目内容
【题目】乙二酸(H2C2O4)是一种重要的化工产品。其制备工艺流程如下:
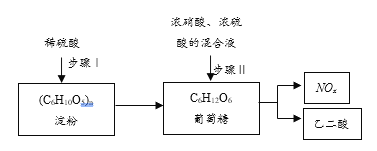
步骤Ⅱ中葡萄糖(结构简式: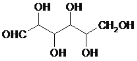 )被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
)被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)步骤Ⅰ中淀粉水解成葡萄糖,使用______试剂可检验淀粉是否完全水解。
(2)步骤Ⅱ的氧化过程需控制反应温度为55~60℃的原因:①温度过低,则_______________;②温度过高,则_________________。
(3)检验氧化后的溶液中是否仍含有葡萄糖的实验方案是_______________。
(4)H2C2O4能使酸性KMnO4溶液褪色,配平离子方程式并标出电子转移的方向和数目。____H2C2O4+____MnO4-+____H+→____CO2↑+____Mn2++____H2O,______________
(5)若尾气NOx中,n(NO2):n(NO)=1:2,则每生产6.3kg乙二酸会产生标准状况下_____________L的NO2。
【答案】碘水或碘酒 反应速率慢 硝酸易挥发、分解 取氧化后溶液加入过量NaOH溶液后再加入新制Cu(OH)2悬浊液,出现砖红色沉淀,则含有葡萄糖 5,2,6,10,2,8C→Mn10e 1344L
【解析】
(1)因为淀粉遇碘单质变蓝,因此可用碘水或碘酒进行检验淀粉是否完全水解。答案:碘水或碘酒;
(2)如果温度过低,会使反应速率过慢,增加反应时间;因为硝酸具有挥发性,若温度过高硝酸会分解(或挥发),所以需控制温度。答案:反应速率慢;硝酸易挥发、分解。
(3)葡萄糖中含有醛基,醛基的检验可用银氨溶液或新制的氢氧化铜溶液进行检验,具体实验方案为:取氧化后溶液加入过量NaOH溶液后再加入新制Cu(OH)2悬浊液,出现砖红色沉淀,则溶液中仍含有葡萄糖。答案:取氧化后溶液加入过量NaOH溶液后再加入新制Cu(OH)2悬浊液,出现砖红色沉淀,则含有葡萄糖。
(4)能使酸性溶液褪色,H2C2O4中C元素化合价由+3升高为+4,KMnO4中Mn元素化合价由+7降为+2,由化合价升降相等原则可知,MnO4-、Mn2+的系数为2, H2C2O4的系数为5,CO2的系数为10,根据电荷守恒可知H+的系数为6,根据氢原子和氧原子守恒可得H2O的系数为8,其离子方程式5H2C2O4+2MnO4-+6H+→10CO2↑+2Mn2++8H2O,所以系数分别为:5,2,6,10,2,8;答案:5,2,6,10,2,8。
(4)6.3kg乙二酸的物质的量为![]() =70mol,设反应生成二氧化氮的乙二酸的物质的量为xmol,则反应生成一氧化氮的乙二酸的物质的量为(70-x)mol,由方程式可知,反应生成的n(NO2)=6xmol,反应生成的n(NO)=2
=70mol,设反应生成二氧化氮的乙二酸的物质的量为xmol,则反应生成一氧化氮的乙二酸的物质的量为(70-x)mol,由方程式可知,反应生成的n(NO2)=6xmol,反应生成的n(NO)=2![]() ,由于n(NO2):n(NO)=1:2,则6xmol:[2
,由于n(NO2):n(NO)=1:2,则6xmol:[2![]() (70-x)mol]=1:2,解得x=10mol,则n(NO2)=6xmol=6
(70-x)mol]=1:2,解得x=10mol,则n(NO2)=6xmol=6![]() 10mol=60mol,标准状况下的体积为60mol
10mol=60mol,标准状况下的体积为60mol![]() 22.4L/mol=1344L。答案:1344L。
22.4L/mol=1344L。答案:1344L。

【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低