题目内容
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
【答案】B
【解析】
X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,则X是H元素,Z是Al元素;由这四种元素组成的单质或化合物存在如图所示转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体,则丙是Fe3O4,结合元素及化合物的性质逆推可知甲为Fe,乙为H2O,丁是H2,戊为金属单质,可以与Fe3O4反应产生Fe单质,因此戊是Al单质,己为Al2O3,结合原子序数的关系可知Y是O元素,W是Fe元素,据此分析解答。
综上所述可知X是H元素,Y是O元素,Z是Al元素,W是Fe元素。甲是Fe单质,乙是H2O,丙是Fe3O4,丁是H2,戊是Al单质,己是Al2O3。
A.Fe原子序数是26,Al原子序数是13,26为13的2倍,金属性Al>Fe,A错误;
B.Fe是26号元素,在元素周期表中位于第四周期VIII族,B正确;
C.丙是Fe3O4,只能与酸反应产生盐和水,不能与碱发生反应,因此不是两性氧化物,C错误;
D.Fe是变价金属,与硝酸反应时,二者的相对物质的量的多少不同,反应失去电子数目不同,可能产生Fe2+,也可能产生Fe3+,而Al是+3价的金属,因此等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量不一定相等,D错误;
故合理选项是B。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
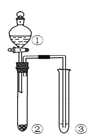
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D