题目内容
下列有关叙述正确的是 ( )
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3) )+c(H2CO3) |
| B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
| C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强 |
| D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-) |
B
解析试题分析:A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
)+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
考点:考查溶液中守恒规律的应用,pH的计算,酸性强弱的判断,离子浓度的比较

练习册系列答案
相关题目
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
| A.溴酸银的溶解时放热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )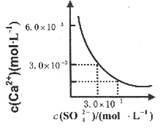
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
下列叙述不正确的是
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<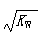 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是
| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.c点时恰好中和 |
| C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一) |
| D.e点时溶液中溶质是CH3COONa和CH3COOH |
某混合溶液中所含离子的浓度如下表,则M离子可能为
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
常温下,pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化)。下列说法正确的是
| A.反应后的溶液呈酸性 |
| B.两种反应物中水电离出的c(H+)都是1×10-12 mol·L-1 |
| C.反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol·L-1 |
| D.反应后的溶液中:c(Na+) >c(CH3COO-)>c( OH-)>c(H+) |