题目内容
ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)白磷单质中的P原子采用的轨道杂化方式是 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 。
(3)As原子序数为 ,其核外M层和N层电子的排布式为 。
(4)NH3的沸点比PH3 (填“高”或“低”),原因是 。
P 的立体构型为 。
的立体构型为 。
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 。
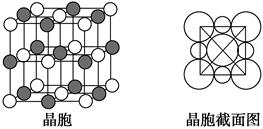
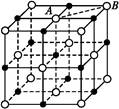
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示)。在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如下页图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为 g(氧离子的半径为1.40×10-10 m)。

(1)白磷单质中的P原子采用的轨道杂化方式是 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 。
(3)As原子序数为 ,其核外M层和N层电子的排布式为 。
(4)NH3的沸点比PH3 (填“高”或“低”),原因是 。
P
 的立体构型为 。
的立体构型为 。 (5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 。
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示)。在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如下页图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为 g(氧离子的半径为1.40×10-10 m)。

(1)sp3 (2)N>P>As
(3)33 3s23p63d104s24p3
(4)高 NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力 正四面体
(5)第一步电离出的氢离子抑制第二步的电离 硝酸中N呈+5价,N—O—H中O的电子更向N偏移,越易电离出氢离子
(6) a
a 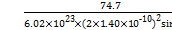 =1.83×10-3
=1.83×10-3
(3)33 3s23p63d104s24p3
(4)高 NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力 正四面体
(5)第一步电离出的氢离子抑制第二步的电离 硝酸中N呈+5价,N—O—H中O的电子更向N偏移,越易电离出氢离子
(6)
 a
a 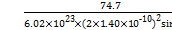 =1.83×10-3
=1.83×10-3
(1)一个P原子与其他3个P原子形成3个σ键,还有一对孤对电子;(4)P的孤对电子对数=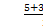 =0,为sp3杂化,正四面体;(6)如图两个最近的阳离子核间的距离为AB;作辅助线,BD垂直AD,∠DAB="60°,BD=AB" sin 60°,设横向上有x个氧离子,纵向上有y个氧离子,横、纵向的长分别为2x·1.40×10-10m、2y·1.40×10-10 m,2x·1.40×10-10 m×2y·1.40×10-10 m×sin60°="1" m2,所以每平方米面积上
=0,为sp3杂化,正四面体;(6)如图两个最近的阳离子核间的距离为AB;作辅助线,BD垂直AD,∠DAB="60°,BD=AB" sin 60°,设横向上有x个氧离子,纵向上有y个氧离子,横、纵向的长分别为2x·1.40×10-10m、2y·1.40×10-10 m,2x·1.40×10-10 m×2y·1.40×10-10 m×sin60°="1" m2,所以每平方米面积上

分散的氧离子个数为x·y=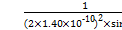 个,NiO的物质的量为
个,NiO的物质的量为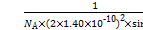 mol,即可求出质量
mol,即可求出质量
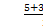 =0,为sp3杂化,正四面体;(6)如图两个最近的阳离子核间的距离为AB;作辅助线,BD垂直AD,∠DAB="60°,BD=AB" sin 60°,设横向上有x个氧离子,纵向上有y个氧离子,横、纵向的长分别为2x·1.40×10-10m、2y·1.40×10-10 m,2x·1.40×10-10 m×2y·1.40×10-10 m×sin60°="1" m2,所以每平方米面积上
=0,为sp3杂化,正四面体;(6)如图两个最近的阳离子核间的距离为AB;作辅助线,BD垂直AD,∠DAB="60°,BD=AB" sin 60°,设横向上有x个氧离子,纵向上有y个氧离子,横、纵向的长分别为2x·1.40×10-10m、2y·1.40×10-10 m,2x·1.40×10-10 m×2y·1.40×10-10 m×sin60°="1" m2,所以每平方米面积上
分散的氧离子个数为x·y=
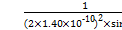 个,NiO的物质的量为
个,NiO的物质的量为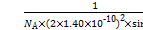 mol,即可求出质量
mol,即可求出质量
练习册系列答案
相关题目

 =1.732)
=1.732)