题目内容
4.下列实验操作能达到预期目的是( )| A. | 配制银氨溶液:向稀的AgNO3溶液中逐滴加入稀氨水至刚好生成沉淀 | |
| B. | 除去苯中的少量苯酚:加入浓溴水然后过滤 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入饱和碳酸钠溶液,充分振荡,静置分液,弃水层 | |
| D. | 检验溴乙烷中的溴:将溴乙烷与NaOH溶液共热后冷却,再滴加AgNO3溶液 |
分析 A.向硝酸银中滴加氨水,至最初生成的沉淀恰好溶解制备银氨溶液;
B.苯是有机溶剂,溴能够溶解于苯;
C.乙酸和碳酸钠反应生成乙酸钠二氧化碳和水;
D.检验溴离子先加硝酸酸化.
解答 解:A.向硝酸银中滴加氨水,至最初生成的沉淀恰好溶解制备银氨溶液,故A错误;
B.苯中混有苯酚,加入溴水,溴易溶于有机溶剂苯,引进了新的杂质,且生成的三溴苯酚也溶于苯中,应该加入NaOH后生成可溶于水的苯酚钠,然后用分液的方法分离,故B错误;
C.加饱和碳酸钠溶液降低乙酸乙酯的溶解度,乙酸和碳酸钠反应生成乙酸钠二氧化碳和水,分液分离,故C正确;
D.溴乙烷与NaOH溶液混合共热,发生水解反应生成溴离子,检验溴离子先加硝酸酸化,再滴加AgNO3溶液,生成浅黄色沉淀可证明,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液的配制、离子检验以及物质的分离提纯等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
2.盛放有较强腐蚀性的试剂瓶的标签上最应有的警示标志是( )
| A. |  | B. |  | C. |  | D. |  |
12.用分液漏斗可以分离的一组混合物是( )
| A. | 溴苯和水 | B. | 乙酸乙酯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
19.反应4NH3+5O2?4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是( )
| A. | v(O2)=0.125mol•(L•s)-1 | B. | v(NO)=0.01mol•(L•s)-1 | ||
| C. | v(NH3)=0.01 mol•(L•s)-1 | D. | v(NH3)=0.2 mol•(L•s)-1 |
9.将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示.下面说法正确的是( )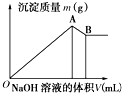

| A. | A点的沉淀是Mg(OH)2、Al(OH)3 | B. | B点的沉淀是Mg(OH)2、Al(OH)3 | ||
| C. | B点的沉淀是Al(OH)3 | D. | A点的沉淀是Mg(OH)2 |
16.硅及其化合物的应用范围很广.下列说法正确的是( )
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
13.下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO | |
| B. | 将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 | |
| D. | 用惰性电极电解MgCI2溶液:2 Cl-+2H2O=CI2↑+H2↑+2OH- |
14.下列有关离子方程式书写正确的是( )
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ | |
| B. | 铜片投入少量FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | Ca(HCO3)2溶液与足量澄清石灰水混合:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
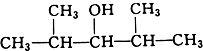 B.
B.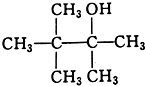
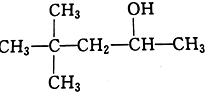 D.CH3(CH2)5CH2OH
D.CH3(CH2)5CH2OH