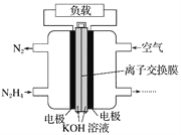
��Ŀ����
����Ŀ��������Ԫ�����ڱ��IJ�ͼ������������ĸ���ŷֱ����ijһ��Ԫ�أ���ش�

��1�����е�ʵ�߱�ʾԪ�����ڱ������ұ߽磬����ʵ�߲�ȫԪ�����ڱ������±߽�____��
��2����������õĽ���������õķǽ����γɵ�������___(�ѧʽ)��
��3����a��d����Ԫ�ؿ��γ����ֻ����д������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽ��___�������ֻ������������Ļ�ѧ����____(����ĸ)��
A.���Թ��ۼ� B.�Ǽ��Թ��ۼ� C.���Ӽ�
��4��e��f��k��m��Ӧ�ĵ�ԭ�����ӵİ뾶�ɴ�С��˳��Ϊ____(�����ӷ���)��
��5��d��m��Ӧ�����ӻ�ԭ����ǿ����˳��Ϊ____(�����ӷ���)��
��6��d��e��m��p����̬�⻯���У���ȶ�����(�����ʽ)____��
��7���õ���ʽ��ʾn��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������γɹ��̣�____��
���𰸡�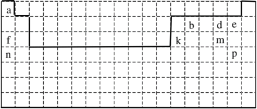 �� KF�� 2H2O2=2H2O+O2���� AB�� S2- >F-> Na+>Al3+�� S2- >O2-�� HBr��
�� KF�� 2H2O2=2H2O+O2���� AB�� S2- >F-> Na+>Al3+�� S2- >O2-�� HBr�� ![]() ��
��
��������
��1��Ԫ�����ڱ����߸����ڣ���һ���ڰ���2��Ԫ�أ��ڶ���������Ϊ�����ڰ���8��Ԫ�أ���������Ϊ�����ڣ���Ԫ�����ڱ����±�����ͼ��ʾ��
��2����������õĽ���������õķǽ����ֱ�ΪK��F�����γɵ�������KF��
��3����a��d����Ԫ�طֱ�ΪH��O�����γ����ֻ�����ΪH2O��H2O2��������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽΪ��2H2O2=2H2O+O2���������ֻ������������Ļ�ѧ���м��Թ��ۼ��ͷǼ��Թ��ۼ�����ѡAB��
��4��e��f��k��m��Ӧ�ĵ�ԭ�����ӷֱ�ΪF-��Na+��Al3+��S2-����뾶�ɴ�С��˳��ΪS2- >F-> Na+>Al3+��
��5��d��m��Ӧ�����ӷֱ�ΪO2-��S2-����ԭ����ǿ����˳��ΪS2- >O2-��
��6��d��e��m��p����̬�⻯���У���ȶ�����HBr��
��7��n��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������K2S�������ʽ��ʾ�γɹ���Ϊ![]() ��
��

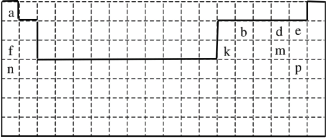
����Ŀ�����������![]() �ֳ�Ī���Σ���dz��ɫ���塣��������
�ֳ�Ī���Σ���dz��ɫ���塣��������![]() ��Ҫ��
��Ҫ��![]() ��
��![]() ��
��![]() �Ʊ�Ī���ε��������£�
�Ʊ�Ī���ε��������£�
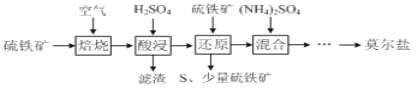
��֪������ԭ��ʱ��![]() ��
��![]() ����Ӧ��
����Ӧ��![]() ͨ����Ӧ��ԭ����Ӧ�����£�
ͨ����Ӧ��ԭ����Ӧ�����£�![]()
![]() д������ԭ��ʱ
д������ԭ��ʱ![]() ��
��![]() ������ԭ��Ӧ������ӷ���ʽ��__________��
������ԭ��Ӧ������ӷ���ʽ��__________��
ʵ���Ҽ�������ԭ������ȫ�ķ�����__________��
![]() ����ԭ��ǰ����Һ�в������ӵ�Ũ�ȼ��±�
����ԭ��ǰ����Һ�в������ӵ�Ũ�ȼ��±�![]() ��Һ����仯���Բ���
��Һ����仯���Բ���![]() ������㷴Ӧ���б���ԭ��Fe
������㷴Ӧ���б���ԭ��Fe![]() �����ʵ���֮��__________��
�����ʵ���֮��__________��
���� | ����Ũ�� | |
��ԭǰ | ��ԭ�� | |
|
|
|
|
|
|
![]() ��ȡ
��ȡ![]() ����Ī���Σ�����ˮ���250mL��Һ��ȡ
����Ī���Σ�����ˮ���250mL��Һ��ȡ![]() ����Һ����������
����Һ����������![]() ��Һ���õ���ɫ����
��Һ���õ���ɫ����![]() ����ȡ
����ȡ![]() ����Һ��
����Һ��![]() ������Һ�ζ�����
������Һ�ζ�����![]() ǡ����ȫ����ԭΪ
ǡ����ȫ����ԭΪ![]() ʱ��������Һ�����Ϊ
ʱ��������Һ�����Ϊ![]() ����ȷ��Ī���εĻ�ѧʽ
����ȷ��Ī���εĻ�ѧʽ![]() ��д���������)________________��
����������)________________��