题目内容
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室采用氧气氧化液态PCl3法制取POCl3,有关物质的部分性质如下表
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0(易挥发) | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
实验装置(加热及夹持仪器略)如下:

(1)甲装置的名称是____________,干燥管的作用是____________
(2)装置C中生成POCl3的化学方程式为______________
(3)装置B的作用除观察气体的流速外,还有________ 、________
(4)反应温度不能过高,原因是______________。
(5)反应一段时间后,待三颈瓶中的液体冷却至室温,准确称取29.1g产品(仅含PCl3杂质),置于盛有60.00 mL蒸馏水的密闭水解瓶中摇动至完全与水反应,将水解液配成100.00 mL溶液,加入AgNO3溶液至恰好完全反应,测得生成的AgCl的质量为86.1g,则产品中POC13的质量分数为___(保留三位有效数字)
【答案】球形冷凝管 防止空气中的水蒸气进入C中 2PCl3+O2=2POCl3 干燥气体 观察是否堵塞 温度过高PCl3易挥发,影响产率 52.7%
【解析】
由制备实验装置可知,A中过氧化氢分解生成氧气,装置B可观察气体的速率、干燥气体、平衡压强,C中氧气氧化液态PCl3 制取POCl3,冷凝管进行冷凝回流,提高利用率。PCl3、POCl3遇水剧烈反应生成含氧酸和氯化氢,干燥管中碱石灰可防止空气中的水蒸气进入三颈烧瓶。
由制备实验装置可知,A中过氧化氢分解生成氧气,装置B可观察气体的速率、干燥气体、平衡压强,C中氧气氧化液态PCl3制取POCl3,冷凝管进行冷凝回流,提高利用率。PCl3、POCl3遇水剧烈反应生成含氧酸和氯化氢,干燥管中碱石灰可防止空气中的水蒸气进入三颈烧瓶。
(1)根据仪器的结构和性能可知甲装置的名称是球形冷凝管;PCl3、POCl3遇水均剧烈反应生成含氧酸和氯化氢,干燥管的作用是:防止空气中的水蒸气进入三颈烧瓶;
(2)装置C中氧气氧化液态PCl3生成POCl3的化学方程式为2PCl3+O2=2POCl3;
(3)C中气体反应后得到液体物质,会使装置内压强减小,若通入氧气过快,反应过快,温度过高,PCl3易挥发,利用率低,且氧气利用也不充分,装置B的作用除观察O2的流速外,还有:平衡压强,防阻塞及干燥O2;
(4)反应温度不能过高,通常控制在60~65℃,原因是:温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低;
(5)设样品中PCl3的物质的量为xmol,POCl3的物质的量为ymol,则137.5x+153.5y=29.1;已经PCl3+3H2O=H3PO3+3HCl、POCl3+3H2O=H3PO4+3HCl、Ag++Cl-=AgCl↓,可知,x+y=![]() n(Cl-)=
n(Cl-)=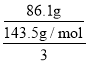 =0.2mol,解得:x=y=0.1,反应产物中 POCl3 的质量百分含量为
=0.2mol,解得:x=y=0.1,反应产物中 POCl3 的质量百分含量为![]() ×100%=52.7%。
×100%=52.7%。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】下列装置或操作能达到目的的是
|
|
|
|
A. 只用装置①的仪器可以测定生成氢气的速率(mL/s)
B. 装置②可依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置③进行中和反应反应热的测定实验
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响








