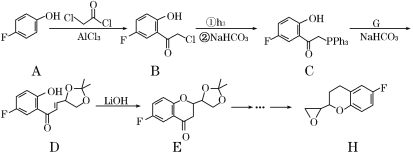
题目内容
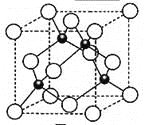
【题目】Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
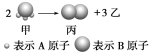
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液: 。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
【答案】
Ⅰ (1) A2
(2) 4dg·mol-1
(3)500ρ/(2d+500) mol/L
Ⅱ(1)CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
(2) HCO3- +Ba2++OH-=BaCO3↓+H2O
(3) NH4++HCO3-+2OH-=NH3+CO32-+2H2O
(4) ClO-+SO2+H2O=SO42- +Cl-+2H+
(5)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- (6)AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-
(7)5Fe2++MnO4-+8H+=5Fe3++Mn2++ 4H2O (8) As2O3+6Zn+12H+=2AsH3↑+6Zn2++3H2O
【解析】
试题分析:Ⅰ、(1)已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,根据结构模型可设甲的分子式为BA3,丙为B2,则乙为A2;
(2)混合气体对氢气的相对密度为d,则生成物的相对分子质量为2d,2mol甲可生成1mol丙和3mol乙,则可知甲的摩尔质量为4d gmol-1;
(3)甲的物质的量为11.2L÷22.4L/mol=0.5mol,质量为0.5mol×4d gmol-1=2d g,500mL水的质量为500g,则溶液的质量为(500+2d)g,溶液的体积为![]() ,则物质的量浓度为
,则物质的量浓度为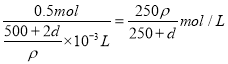 。
。
Ⅱ、(1)贝壳溶于醋酸溶液的离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑。
(2)向氢氧化钡溶液中加入少量小苏打溶液的离子方程式为HCO3- +Ba2++OH-=BaCO3↓+H2O。
(3)碳酸氢铵和足量浓烧碱溶液混合反应的离子方程式为NH4++HCO3-+2OH-=NH3+CO32-+2H2O。
(4)向次氯酸钠溶液中通足量SO2气体发生氧化还原反应的离子方程式为ClO-+SO2+H2O=SO42- +Cl-+2H+。
(5)向溴化亚铁溶液中通入足量氯气的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。
(6)向偏铝酸钠溶液中通入足量CO2气体的离子方程式为AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液发生氧化还原反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++ 4H2O。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢的离子方程式为As2O3+6Zn+12H+=2AsH3↑+6Zn2++3H2O。

 名校课堂系列答案
名校课堂系列答案