题目内容
【题目】钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
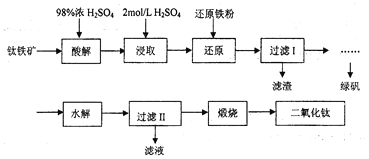
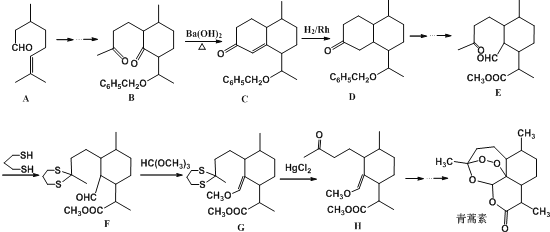
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
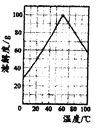
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
【答案】
(1)FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(2)B
(3)粉碎矿石、适量处长浸取时间等
(4)将溶液中的Fe3+还原成Fe2+
(5)加热浓缩到60℃饱和溶液,冷却至0℃结晶、过滤,少量冰水洗涤、低温干燥
(6)促进TiOSO4和Ti2(SO4)3的水解,防止Fe2+水解而造成产物不纯
【解析】
试题分析:(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)5gFeTiO3的物质的量为![]() ,98%浓硫酸物质的量浓度 为18.4mol/L,根据反应FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,可计算出消耗浓硫酸的体积约为5.4mL,根据FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,可计算出消耗浓硫酸的体积约为3.5mL,则最接近的浓硫酸的用量为6mL,答案为B。
,98%浓硫酸物质的量浓度 为18.4mol/L,根据反应FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,可计算出消耗浓硫酸的体积约为5.4mL,根据FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,可计算出消耗浓硫酸的体积约为3.5mL,则最接近的浓硫酸的用量为6mL,答案为B。
(3)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法,即采用将熔块粉碎(或连续搅拌、适当升高温度等)方法;
(4)根据2Fe3++Fe=3Fe2+可知,加“还原铁粉”的目的是将溶液里的Fe3+还原为Fe2+;
(5)请根据FeSO4溶解度曲线,从过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作为加热浓缩到60℃饱和溶液,冷却至0℃结晶、过滤,少量冰水洗涤、低温干燥;
(6)水解是吸热过程,将滤液加热至90℃作用是促进TiOSO4和Ti2(SO4)3的水解;沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因防止Fe2+水解而造成产物不纯。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案