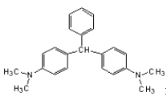
��Ŀ����
����Ŀ��ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ����������
�ش��������⣺
��1��W+�ļ۵����Ų�ʽΪ ��
��2��Y2X2������Yԭ�ӹ�����ӻ�����Ϊ ��1mol Y2X2������������ĿΪ ��
��3��������ZX3�ķе�Ȼ�����YX4�ĸߣ�����Ҫԭ���� ��
��4��Ԫ��Y��һ����������Ԫ��Z��һ�������ﻥΪ�ȵ����壬Ԫ��Z������������ķ���ʽ�� ��
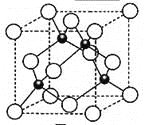
��5��Ԫ��W��һ���Ȼ��ᄃ��ľ����ṹ��ͼ��ʾ�����Ȼ���Ļ�ѧʽ�� ��������Ũ���ᷢ����������ԭ��Ӧ�����������H2WCl3����Ӧ�Ļ�ѧ����ʽΪ ���ھ����������2��ԭ�Ӿ�����apm���������ܶ���_____________g��cm-3(ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
���𰸡���1��3d10
��2��sp�ӻ���3NA��3��6.02��1023��(2��)
��3��NH3���Ӽ�������
��4��N2O(2��)
��5��CuCl ��CuCI+2HCI = H2CuCl3 (��CuCl+2HCl = H2[CuCl3]��![]()
�����������������ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ���XΪHԪ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2��������������������8�������ڲ������ֻ����2������������Ϊ4����Y��CԪ�أ�Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵ��ӣ���Xԭ�Ӻ�������Ų�Ϊ1s22s22p6����ZΪNԪ�أ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ����������ԭ�Ӻ��������Ϊ2+8+18+1=29����WΪCu��
��1��Cu+�ļ۵����Ų�ʽΪ��3d10��
��2��C2H2���ӽṹʽΪH-C��C-H��Cԭ��û�й¶Ե��ӣ��γ�2���������ӻ������ĿΪ2��Cԭ���ӻ�������ӻ�����Ϊsp�ӻ���1mol C2H2������������ĿΪ3��6.02��1023����
��3��������NH3����֮���γ��������CH4���Ӳ��ܣ��ʰ����е�ϸߣ�
��4���ȵ����庬����ͬԭ����Ŀ��۵���������Ԫ��̼��һ����������Ԫ�ص���һ�������ﻥΪ�ȵ����壬ΪCO2��N2O��
��5�������к�ɫ����ĿΪ4����ɫ����ĿΪ8��![]() +6��
+6��![]() =4���ʸ��Ȼ���Ļ�ѧʽ��CuCl��������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪ��CuCl+2HCl=H2CuCl3��
=4���ʸ��Ȼ���Ļ�ѧʽ��CuCl��������Ũ���ᷢ����������ԭ��Ӧ�����������H2CuCl3����Ӧ�Ļ�ѧ����ʽΪ��CuCl+2HCl=H2CuCl3��
�����к�ɫ������Χ��4����ɫ���γ���������ṹ���ھ����������2��ԭ�Ӿ�����apm������Խ��߳���Ϊ4a pm�����ⳤΪ![]() pm����������Ϊ4��
pm����������Ϊ4��![]() g���������ܶ���4��
g���������ܶ���4��![]() gg��(
gg��(![]() ��10-10cm)3=
��10-10cm)3=![]() gcm-3��
gcm-3��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�����Ŀ������ͭ���壬�׳����������������д��£�����ⶾ��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��1���ⶨ�������ھ��������������____________������SO42-��Sԭ�ӵĹ���ӻ���ʽ��____________��H2O�Ŀռ乹����__________________��
��2��������ͭ������ȵ�258~680�����ɵ�����A��A��__________����ѧʽ����A����ˮ�����Һ�����백ˮ���۲쵽��������_____________________________________________�����յõ���Һ�еĺ�ͭԪ�ص�������_________________����ѧʽ���������Ӻ��еĻ�ѧ��������___________________��
��3��������ͭ������ȵ�1000���������ɵ�����C����C�е�ͭ�����ӵĻ�̬�����Ų�ʽ��____________��
��4����ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���������ͺ��������ͬ��ԭ������
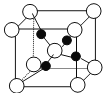
�����¶���_______________��
��ͭԭ�ӵ���λ����_______________��
����֪�þ�����ܶ�Ϊdg��cm-3����������_________________pm��