题目内容
【题目】如图是一种常见烃的含氧衍生物分子的比例模型.关于该物质的说法正确的是( ) 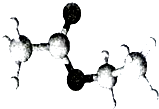
A.无色无味、易溶子水的液体
B.具有酸性,能使石蕊试液变红
C.含有羟基,能与金属Na反应
D.含有酯基,能发生水解反应
【答案】D
【解析】解:由球棍模型可知,该有机物为CH3COOCH2CH3 ,
A.酯类物质不溶于水,故A错误;
B.含有酯基,不具有酸性,故B错误;
C.不含羟基,与钠不反应,故C错误;
D.为乙酸乙酯,含有酯基,可发生水解反应,故D正确.
故选D.
【考点精析】掌握有机物的结构和性质是解答本题的根本,需要知道有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

练习册系列答案
相关题目




