题目内容
【题目】一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是
A. 若升高温度,X的体积分数增大,则正反应的△H>0
B. 将容器体积变为20L,Z的平衡浓度变为原来的1/2
C. 以X浓度变化表示的反应速率为0.001mol/(L·s)
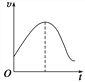
D. 若右图纵坐标是正反应速率,则反应应该在绝热条件下进行,图像最高点为平衡点
【答案】C
【解析】A、升高温度,X的体积分数增大,说明平衡向逆反应方向移动,即正反应是放热反应,△H<0,故错误;B、假设平衡不移动,Z的平衡浓度变为原来的1/2,但反应前后气体系数之和不相等,缩小体积平衡向逆反应方向移动,消耗Z,Z的浓度小于原来的1/2,故错误;C、生成0.3molZ的同时消耗X的物质的量为0.3×2mol=0.6mol,根据化学反应速率的定义,v(X)=0.6/(60×10)mol/(L·s)=0.001 mol/(L·s),故正确;D、纵坐标代表正反应速率,随着反应进行,正反应速率降低,且不清楚此反应是放热还是吸热反应,故错误。

练习册系列答案
相关题目